
【题目】常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中正确的是

A. MOH为一元强碱
B. K点对应的溶液中:c(M+) + c(MOH) = c(A-)
C. K点对应的溶液中:c(MOH)+c(OH-)-c (H+)=0.005 mol·L-1
D. N点水的电离程度小于K点水的电离程度
【答案】C
【解析】A、假设HA是强酸,0.01mol·L-1HA中c(H+)=0.01mol·L-1,其pH=2,符合滴定的起点,说明假设正确,HA为一元强酸,假设MOH是强碱,加入50mLMOH,恰好完全反应,此时溶液的pH=7,但根据滴定曲线,当加入51mLMOH溶液达到中性,MOH过量,说明MOH属于一元弱碱,故A错误;B、根据物料守恒,K点时M元素总物质的量是A-物质的量的2倍,即c(M+)+c(MOH)=2c(A-),故B错误;C、K点的溶质为MOH和MA,根据电荷守恒:c(M+)+c(H+)=c(A-)+c(OH-),根据物料守恒:c(M+)+c(MOH)=2c(A-),两式合并为c(MOH)+c(OH-)-c(H+)=c(A-)=0.005mol·L-1;故C正确;D、K点,溶液中MOH的浓度大于N点时MOH的浓度,N点对水的电离抑制能力小于K点,即N点的水的电离程度大于K点,故D错误。


 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式表达正确的是
A. 硫酸亚铁酸性溶液中加入过氧化氢:2Fe2++ H2O2 +2H+= 2Fe3++2H2O
B. 用食醋除水垢:CaCO3+2H+=Ca2++CO2↑+H2O
C. 向NaClO溶液中通入少量SO2: 2C1O-+SO2+H2O=SO32-+2HClO
D. Na2S溶于水呈碱性:S2-+ 2H2O![]() H2S +2OH-
H2S +2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某石灰乳中缓慢通入氯气,随着反应的进行,温度升高开始产生Ca(ClO3)2。ClO-、ClO![]() 两种离子的物质的量(n)与反应时间(t)的关系曲线如图所示(不考虑氯气和水的反应)。
两种离子的物质的量(n)与反应时间(t)的关系曲线如图所示(不考虑氯气和水的反应)。
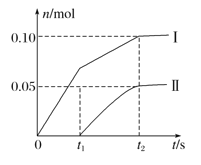
(1)由图可知ClO-、ClO![]() 两种离子的物质的量之比为__________。
两种离子的物质的量之比为__________。
(2)所取石灰乳中含有Ca(OH)2的物质的量为______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:
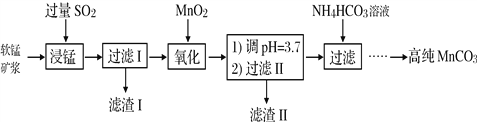
(1)浸锰过程中Fe2O3与SO2反应的化学方程式为Fe2O3+ SO2+2H+=2Fe2++ SO42-+ H2O,该反应是经历以下两步反应实现的。写出ⅱ的离子方程式:_____________。
ⅰ:Fe2O3 + 6H+ = 2Fe3++3H2O
ⅱ:……
(2)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为_____________(填离子符号)。
(3)写出氧化过程中MnO2与SO2反应的化学方程式:_________________。
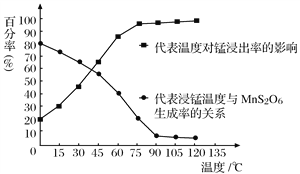
(4)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是_________;向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度不宜太高的原因是___________________。
(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有气体生成,写出反应的离子方程式:___________________。
(6)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下实验:
①称量1.00 g样品溶于水,配成250 mL溶液;
②用碱式滴定管准确量取25.00 mL所配溶液于锥形瓶中,滴加2~3滴酚酞溶液;
③用0.10 mol/L的标准盐酸滴定并重复三次,每次实验数据记录如下
滴定序号 | 待测液体积(mL) | 所消耗盐酸标准溶液的体积(mL) | |
滴定前 | 滴定后 | ||
1 | 25.00 | 0.50 | 20.60 |
2 | 25.00 | 6.00 | 26.00 |
3 | 25.00 | 1.10 | 21.00 |
请回答:
(1)排去碱式滴定管中气泡的方法应采用下图中的操作 ,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
![]()

![]()
甲 乙 丙
(2)滴定过程中用左手控制 (填仪器及部位),眼睛注视 ,直至滴定终点。
(3)判断滴定终点到达时的现象为 。
(4)若出现下列情况,测定结果偏高的是 。÷
a.滴定前用蒸馏水冲洗锥形瓶
b.滴定过程中振荡锥形瓶时不慎将瓶内溶液溅出
c.滴定过程中不慎将数滴酸液滴在锥形瓶外
d.酸式滴定管在滴定前有气泡,滴定后气泡消失
(5)通过计算可知该烧碱样品的纯度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将 1mol X 和 2mol Y 充入容积为 1L 的密闭容器中,分别在 250℃和 T℃下发生反应:X(g)+2Y(g)![]() Z(g) △ H,Z 的物质的量随时间变化如右图。下列说法正确的是( )
Z(g) △ H,Z 的物质的量随时间变化如右图。下列说法正确的是( )
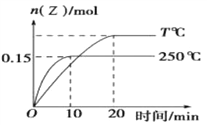
A. △ H > 0
B. 250 ℃时,0~l0min, v(Y)=0.015mol/(L·min)
C. 其他条件不变若减小容器体积,X 的体积分数增大
D. T℃,20min 时再充入 1molX 和 2molY,重新达到平衡时 Y 的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列各有机物的结构简式或分子式:
(1)相对分子质量为84的烃的分子式为__________。
(2)某炔烃和H2充分加成生成2,5—二甲基己烷,则该炔烃的结构简式为________。
(3)0.2 mol烃A在氧气中完全燃烧后生成1.2 mol CO2和1.2 mol H2O,催化加氢后生成2,2—二甲基丁烷,则烃A的结构简式为__________。
(4)某烃1 mol和2 mol HCl完全加成,生成的氯代烷最多还可以与4 mol氯气反应,则该烃的结构简式为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com