
在标准状况下将1.92 g铜粉投入一定量浓HNO3中,随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到由NO2和NO组成的混合气体1.12 L,则反应消耗HNO3的物质的量为 ( )
A.0.8 mol B.0.6 mol
C.0.11 mol D.无法计算
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
一定温度下,在容积为1 L的密闭容器中,存在如下关系:xH2O(g)(H2O)x(g),反应物和生成物的物质的量随时间的变化关系如图。下列说法不正确的是( )
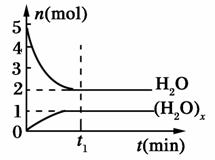
A.x=3
B.该温度下,反应的平衡常数为0.125 L2/mol2
C.平衡时混合气体的平均摩尔质量是33.3 g/mol
D.t1时刻,保持温度不变,再充入1 mol H2O(g),重新达到平衡时,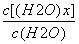 将增大
将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
| 温度/℃ | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
(1)①写出工业合成氨的化学方程式:________________。
②由表中数据可知该反应为放热反应,理由是________。
③理论上,为了增大平衡时H2的转化率,可采取的措施是______
(填字母序号)。
a.增大压强
b.使用合适的催化剂
c.升高温度
d.及时分离出产物中的NH3
(2)原料气H2可通过反应CH4(g)+H2O(g)CO(g)+3H2(g)获取,已知该反应中,当初始混合气中的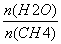 恒定时,温度、压强对平衡混合气中CH4含量的影响如图所示:
恒定时,温度、压强对平衡混合气中CH4含量的影响如图所示:
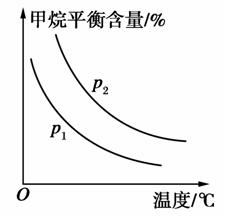
①图中,两条曲线表示压强的关系是p1________p2(填“>”、“=”或“<”)。
②该反应为________反应(填“吸热”或“放热”)。
(3)原料气H2还可通过反应CO(g)+H2O(g)CO2(g)+H2(g)获取。
①T ℃时,向容积固定为5 L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,则平衡时CO的转化率为________该温度下反应的平衡常数K值为________。
②保持温度仍为T ℃,改变水蒸气和CO的初始物质的量之比,充入容积固定为5 L的容器中进行反应,下列描述能够说明体系处于平衡状态的是________________(填字母序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO)n(H2O)n(CO2)n(H2)=11666
查看答案和解析>>
科目:高中化学 来源: 题型:
将容积为50 mL的量筒充满二氧化氮和氧气的混合气体,将量筒倒置在盛满水的水槽里,一段时间后,量筒里剩余气体体积为5 mL。则原混合气体中NO2和O2体积比可能是__________或________。
查看答案和解析>>
科目:高中化学 来源: 题型:
判断下列说法是否正确,不正确的说明理由。
①氨气溶于水能导电,所以氨气是电解质。
②实验室用浓氨水与NaOH固体制取氨气。
③氨与酸反应生成铵盐,与挥发性酸相遇时能形成白烟。
④某晶体与NaOH共热放出一种使湿润的红色石蕊试纸变蓝的气体,该晶体中含有NH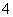 。
。
⑤氨水中含氮微粒中最多的微粒是NH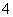 。
。
⑥把NH3通入稀HNO3中,当溶液的pH等于7时,是NH3和HNO3等物质的量反应。
⑦液氨作为清洁能源的反应原理是4NH3+5O2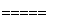 4NO+6H2O。
4NO+6H2O。
⑧氨水中物质的量浓度最大的粒子是NH3·H2O(除水)。
⑨在1 mol·L-1氨水中,NH3·H2O、NH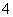 、NH3的物质的量浓度之和为1 mol·L-1。
、NH3的物质的量浓度之和为1 mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
NH3是一种重要的化工原料,可以制备一系列物质(如图)。下列有关表述正确的是( )
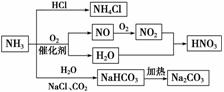
A.NH4Cl和NaHCO3都是常用的化肥
B.NH4Cl、HNO3和Na2CO3受热时都易分解
C.NH3和NO2在一定条件下可发生氧化还原反应
D.图中所涉及的盐类物质均可以水解
查看答案和解析>>
科目:高中化学 来源: 题型:
硝酸铜是制备CuZnAl系催化剂的重要原料,制取硝酸铜现有三种设计方案可供选用:
①Cu与稀硝酸反应制取:3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O ②Cu与浓硝酸反应制取:Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O ③通氧气于铜屑与稀硝酸的体系中制取:2Cu+4HNO3+O2===2Cu(NO3)2+2H2O
下列说法正确的是 ( )
A.制取相同量的硝酸铜需硝酸的量③最多
B.制取相同量的硝酸铜①产生的有毒气体比②多
C. 三种方案中硝酸的利用率③>①>②
三种方案中硝酸的利用率③>①>②
D.三种方案的反应都可以在铁制容器中进行
查看答案和解析>>
科目:高中化学 来源: 题型:
物质A~G是中学化学中常见的物质,这些物质有如图所示的转化关系(部分反应物、生成物没有列出)。其中A、B、F含有一种相同的元素,C、D、G含有一种相同的元素,F具有磁性,G为黑色非金属单质。
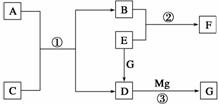
(1)物质A溶解于盐酸,然后加入KSCN溶液,溶液不变色,再滴加几滴氯水,溶液变为血红色,由此推知A的化学式为__________。
(2)反应③的化学方程式是_______________________________________________。
(3)写出下列物质的化学式:E__________、F__________。
(4)若C是一种气体,在温度为1 100 ℃的某固定容积的密闭容器中发生反应:A(s)+C(g)B(s)+D(g) ΔH=a kJ·mol-1(a>0),该温度下平衡常数K=0.263。若生成1 mol B,则吸收的热量________(选填“大于”、“等于”或“小于”)a kJ;若加入过量的A,则C的转化率________(选填“升高”、“不变”或“降低”);若容器内压强不再随时间变化,则该反应__________(选填“达到”、“未达到”或“不一定达到”)化学平衡状态;该反应达到化学平衡状态时,若[C]=0.100 mol·L-1,则[D]=________mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com