
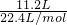 =0.5mol,故A正确;
=0.5mol,故A正确;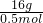 =32g/mol,
=32g/mol,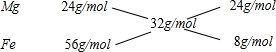
 =0.375mol,根据镁原子守恒可知镁的物质的量等于硫酸镁的物质的量,所以
=0.375mol,根据镁原子守恒可知镁的物质的量等于硫酸镁的物质的量,所以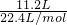 =0.5mol,根据H原子守恒可知氢气的物质的量等于溶质硫酸的物质的量,所以该稀硫酸物质的量浓度为
=0.5mol,根据H原子守恒可知氢气的物质的量等于溶质硫酸的物质的量,所以该稀硫酸物质的量浓度为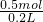 =2.5mol/L,故D错误.
=2.5mol/L,故D错误.

科目:高中化学 来源: 题型:
| A、铝是金属,与强碱不能发生反应 | B、Na、Mg、Fe金属单质在一定条件下与水反应都生成H2和对应的碱 | C、将混有少量SO2的二氧化碳气体通入饱和NaHCO3溶液,可达到除杂的目的 | D、过量的铜与浓硝酸反应,生成的气体只有NO2 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年陕西省高三上学期第三次教学质量检测理综化学试卷(解析版) 题型:填空题
金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如下,回答下列问题:

(1)钛铁矿和浓硫酸反应的产物之一是TiOSO4,反应中无气体生成。副产品甲俗称“绿矾”其化学式是________________。
(2)上述生产流程中加入Fe屑的目的是 (用离子方程式表示),检验副产品甲是否变质的实验方法是 。
(3)上述生产流程中所得到的金属钛中混有少量杂质,可加入 溶解后除去。
(4)溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
|
氢氧化物 |
Fe(OH)2 |
TiO(OH)2 |
Mg(OH)2 |
|
Ksp |
8.0×10-16 |
1.0×10-29 |
1.8×10-11 |
①常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol/L,当pH等于_________时,Mg(OH)2开始沉淀。
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,写出该反应的离子方程式:__________________________________________________________________
(5)Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应控制的反应条件是__________________________
(6)在800--1000℃时电解TiO2也可制得海绵钛,装置如图所示。图中b是电源的______极,阴极的电极反应式________________。

查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省中山市高三上期末统一考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.铝是金属,与强碱不能发生反应
B.Na、Mg、Fe金属单质在一定条件下与水反应都生成H2和对应的碱
C.将混有少量SO2的二氧化碳气体通入饱和NaHCO3溶液,可达到除杂的目的
D.过量的铜与浓硝酸反应,生成的气体只有NO2
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com