
【题目】(1)已知:2N2O5(g )=2N2O4( g )+O2( g ) H1=-4.4kJ·mol-1
2NO2( g)=N2O4(g ) H2 =-55.3kJ·mol-1
则反应N2O5( g )=2NO2(g )+![]() O2(g )的H=_______ kJ·mol-1
O2(g )的H=_______ kJ·mol-1
(2)2molCH3OH(l)在O2(g)中完全燃烧,生成CO2(g)和H2O(l),放出887kJ热量:请写出CH3OH燃烧热的热化学方程式__________________________________
【答案】+53.1 CH3OH( l)+![]() O2(g )=CO2( g )+2H2O(l) H=-443.5kJ·mol-1
O2(g )=CO2( g )+2H2O(l) H=-443.5kJ·mol-1
【解析】
(1)根据盖斯定律,方程式如何叠加, 焓变就如何叠加;
(2)根据题目信息,计算焓变,写出热化学方程式即可。
(1)第一个反应编号①,第二个反应编号②,![]() 得到目标方程式,故目标反应焓变为
得到目标方程式,故目标反应焓变为![]() ,
,
故答案为:+53.1;
(2)2mol![]() 在
在![]() 中完全燃烧,生成
中完全燃烧,生成![]() 和
和![]() ,放出887kJ热量,故1mol甲醇完全燃烧放出443.5kJ热量,燃烧热为1mol可燃物完全燃烧,故热化学方程式为:CH3OH( l)+
,放出887kJ热量,故1mol甲醇完全燃烧放出443.5kJ热量,燃烧热为1mol可燃物完全燃烧,故热化学方程式为:CH3OH( l)+![]() O2(g )=CO2( g )+2H2O(l) H=-443.5kJ·mol-1 ,
O2(g )=CO2( g )+2H2O(l) H=-443.5kJ·mol-1 ,
答案为:CH3OH( l)+![]() O2(g )=CO2( g )+2H2O(l) H=-443.5kJ·mol-1。
O2(g )=CO2( g )+2H2O(l) H=-443.5kJ·mol-1。


科目:高中化学 来源: 题型:
【题目】二氧化硫为重要的含硫化合物,是形成酸雨的主要污染物之一。
(1)在实验室中,若用70%的硫酸溶液和亚硫酸钠粉末反应制取二氧化硫,并要求方便控制反应速率,可选用下图所示气体发生装置中的_____(填下列序号字母)。

(2)SO2经催化氧化可生成SO3,该反应的热化学方程式为:2SO2(g)+O2(g)![]() 2SO3(g) △H="a" kJ·mol-1;在T1℃时,将2 mol SO2、1mol O2充入容积为2 L的密闭容器A中,充分反应并达到平衡,此过程中放出热量98.3 kJ,测得SO2的平衡转化率为50%,则a=_____,T1℃时,上述反应的平衡常数K1=____L·mol-1。若将初始温度为T1℃的2 mol SO2和1 molO2充入容积为2 L的绝热密闭容器B中,充分反应,在T2℃时达到平衡,在此温度时上述反应的平衡常数为K2。则K1______K2(填“>”、“<”或“=”)。
2SO3(g) △H="a" kJ·mol-1;在T1℃时,将2 mol SO2、1mol O2充入容积为2 L的密闭容器A中,充分反应并达到平衡,此过程中放出热量98.3 kJ,测得SO2的平衡转化率为50%,则a=_____,T1℃时,上述反应的平衡常数K1=____L·mol-1。若将初始温度为T1℃的2 mol SO2和1 molO2充入容积为2 L的绝热密闭容器B中,充分反应,在T2℃时达到平衡,在此温度时上述反应的平衡常数为K2。则K1______K2(填“>”、“<”或“=”)。
(3)某热电厂上空大气中所含二氧化硫严重超标,现对该区域雨水样品进行探究。首先用pH试纸测定雨水样品的pH,操作方法为___________________________,测得样品pH约为3;为进一步探究由SO3所形成酸雨的性质,将一定量的SO2通入蒸馏水中,配成pH为3的溶液,然后将溶液分为A、B两份,向A中加入适量的NaOH固体,使溶液恰好呈中性(不考虑氧化性物质和其它酸性物质的影响),则此中性溶液中离子的浓度间存在的关系式为:[Na+]=______________;将溶液B久置于空气中,与久置前相比,久置后的溶液B中水的电离程度将__________(填“增大”、“减小”或“不变”)。
(4)工业上常用如下图所示的流程处理工业尾气中的SO2:

上述流程中有一种物质可以再生循环利用,该物质再生的化学方程式为_______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示一个电解池,装有电解液a、X、Y是两块电极板,通过导线与直流电源相连,请回答以下问题:
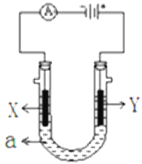
(1)若X、Y是惰性石墨电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴石蕊试液,在X极附近观察到的现象是______________________________;Y电极上的电极反应式是 ___________________,电解NaCl溶液的离子方程式是________________________________。
(2)若要在铜制品上镀Ag,则电解质溶液a可为___________________,Y电极反应式为_________________________________。
(3)若上图装置中的电源为甲醇—空气—KOH溶液的燃料电池,则电池负极的电极反应式_________________,电池工作过程中,正极附近的pH将______(填“增大、减小或不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容中发生下列反应aA(g)![]() cC(s)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(s)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时D的浓度为原平衡的1.8倍,下列叙述正确的是
( )
A.A的转化率变小B.平衡向正反应方向移动
C.D的体积分数变大D.可能a > d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:
2NH3(g)+NO(g)+NO2(g) ![]() 2N2(g)+3H2O
2N2(g)+3H2O![]()
在恒容的密闭容器中,下列有关说法正确的是
A. 平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
B. 平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C. 单位时间内消耗NO和N2的物质的量比为1:2时,反应达到平衡
D. 其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下的恒容密闭容器中,当下列物理量不再变化时,能说明反应:A(s)+2B(g) ![]() C(g)+D(g)已达到平衡状态的是
C(g)+D(g)已达到平衡状态的是
A. 混合气体的压强 B. 混合气体的密度 C. v正(C)=2v逆(B) D. 气体的总物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大危害,必须进行处理.常用的处理方法有两种.方法1:还原沉淀法.
该法的工艺流程为:
其中第①步存在平衡2CrO42(黄色)+2H+Cr2O32(橙色)+H2O
(1)若平衡体系的pH=2,该溶液显______色.
(2)能说明第①步反应达平衡状态的是_____(填序号)
A.Cr2O72和CrO42的浓度相同
B.2v(Cr2O72)=v(CrO42)
C.溶液的颜色不变
(3)第②步中,还原1molCr2O72离子,需要______mol的FeSO47H2O.
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至______.
方法2:电解法.
该法用Fe做电极电解含Cr2O72的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生
Cr(OH)3沉淀.
(5)用Fe做电极的原因为______(用电极反应式解释).
(6)在阴极附近溶液pH升高,溶液中同时生成的沉淀还有______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氧有机物甲可用来制取多种有用的化工产品,合成路线如图:
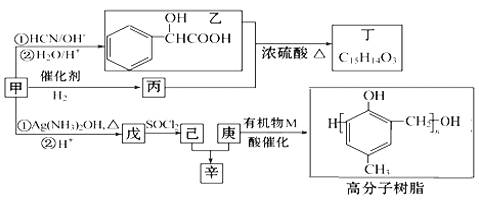
已知:Ⅰ.RCHO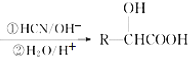
Ⅱ.RCOOH![]() RCOCl
RCOCl![]() RCOOR’(R、R’代表烃基)
RCOOR’(R、R’代表烃基)
(1)甲的含氧官能团的名称是___。写出检验该官能团常用的一种化学试剂的名称___。
(2)写出己和丁的结构简式:己__,丁__。
(3)乙有多种同分异构体,属于甲酸酯,含酚羟基,且酚羟基与酯的结构在苯环邻位的同分异构体共有___种。
(4)在NaOH溶液中发生水解反应时,丁与辛消耗NaOH的物质的量之比为__。
(5)庚与M合成高分子树脂的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(化学反应原理)
25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH的电离平衡常数表达式__。
(2)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为__。
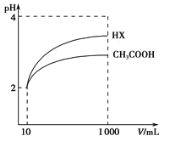
(3)体积均为l00mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数___(填“大于”、“小于”或“等于”)醋酸的电离平衡常数。
Ⅱ.(化学与生活)
防治环境污染,改善生态环境已成为全球共识。
(1)燃煤气化有助于减少PM2.5,写出焦炭与水蒸气反应的化学方程式___。
(2)采用焚烧处理垃圾进行发电已在江苏投入使用。下列是生活中的常见垃圾:
A.废纸 B.废电池 C.易拉罐 D.玻璃瓶 E.塑料制品
在焚烧处理前,除废电池外,还有___(填字母)应剔除并回收,随意丢弃电池造成的主要危害是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com