
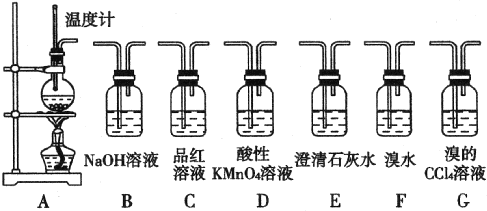
分析 (1)温度计的位置取决于所测量的物质;乙醇沸点低,加热容易产生爆沸;
(2)二氧化硫具有漂白性,可以使品红溶液褪色;
依据乙烯不与氢氧化钠反应,二氧化硫能与氢氧化钠反应,乙烯具有还原性,能使酸性高锰酸钾褪色解答;
依据乙烯具有还原性能使溴的四氯化碳褪色,二氧化硫不与溴的四氯化碳反应的性质解答;
(3)D前面的石灰水无明显变化说明乙醇碳化生成的二氧化碳和二氧化硫都被氢氧化钠吸收,D后面的石灰水变混浊,说明混合气体通入到酸性的高锰酸钾中发生反应产生了能够使澄清石灰水变浑浊的气体,结合乙烯的结构特点分析解答;
(4)在浓硫酸存在条件下加热到170℃,乙醇发生消去反应生成乙烯,据此写出反应的化学方程式.
解答 解:(1)浓硫酸和乙醇制取乙烯时,应严格控制反应物乙醇浓硫酸混合液的温度在170度,所以温度计测量的是混合液的稳定,温度计水银球部分没有插入液面以下;乙醇沸点低,加热时容易发生爆沸,加热碎瓷片可以防止爆沸,
故答案为:温度计水银球部分没有插入液面以下;防爆沸;
(2)若A中所得气体含有SO2,则通到盛有品红溶液的C中,可以使品红溶液褪色;
将混合气体先通入B,用氢氧化钠吸收生成的二氧化硫,然后通入盛有酸性的高锰酸钾的D装置,若高锰酸钾褪色则可证明乙烯的存在,
故答案为:C;D;
(3)D前面的石灰水无明显变化说明乙醇碳化生成的二氧化碳和二氧化硫都被氢氧化钠吸收,D后面的石灰水变混浊,说明混合气体通入到酸性的高锰酸钾中发生反应产生了能够使澄清石灰水变浑浊的气体,而乙烯含有不饱和键具有还原性,能被高锰酸钾氧化,
故答案为:乙烯被酸性KMnO4溶液氧化成CO2;
(4)实验室中通过乙醇的消去反应制取乙烯,反应的化学方程式为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,
故答案为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
点评 本题考查了性质实验方案的设计,题目难度中等,注意掌握乙醇发生消去反应原理及乙烯的实验室制法,试题侧重考查学生分析问题,设计实验的能力,明确各种气体的性质是本题解题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 吸收92KJ | B. | 放出92kJ | C. | 吸收184kJ | D. | 放出184KJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
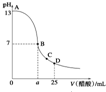 25℃时,在25mL 0.1mol•L-1的NaOH溶液中,逐滴加入0.2mol•L -1的CH3COOH溶液,溶液的pH与醋酸体积关系如图所示,下列分析不正确的是( )
25℃时,在25mL 0.1mol•L-1的NaOH溶液中,逐滴加入0.2mol•L -1的CH3COOH溶液,溶液的pH与醋酸体积关系如图所示,下列分析不正确的是( )| A. | B点的横坐标a>12.5 | |
| B. | C点时溶液中有:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | D点时溶液中有:c(CH3COO-)+c(CH3COOH)=2c(Na+) | |
| D. | 曲线上A、B间的任意一点,溶液中都有:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;反应类型:加聚反应.
;反应类型:加聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl | B. | CO2 | C. | NH3 | D. | CO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 叠氮化钠(NaN3)是一种无色晶体,常见的两种制备方法为2NaNH2+N2O=NaN3+NaOH+NH3,3NaNH2+NaNO3=NaN3+3NaOH+NH3↑.
叠氮化钠(NaN3)是一种无色晶体,常见的两种制备方法为2NaNH2+N2O=NaN3+NaOH+NH3,3NaNH2+NaNO3=NaN3+3NaOH+NH3↑. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该元素位于元素周期表的第三周期ⅦA族 | |
| B. | 生成的盐含有的化学键既有离子键又有共价键 | |
| C. | 该元素的常见化合价有:-1、0、+1、+3、+5、+7等 | |
| D. | 该元素的氢化物的稳定性比PH3、H2S弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
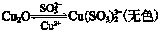
| 操作 | 现象 |
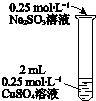 | i 有黄色沉淀出现,随着 Na2SO3溶液的滴入,沉淀增加,当加到5mL时,溶液的蓝色消失. ii 将试管加热,黄色沉淀变为砖红色,有刺激性气味气体产生. iii在加热条件下,继续滴入Na2SO3溶液,砖红色沉淀减少,当1加到10mL时,沉淀完全溶解,得无色溶液. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com