
分析 (1)同周期自左而右,第一电离能整体呈增大,电负性增大;
(2)p轨道最多排6个电子,如果p轨道半满,则p轨道排列3个电子,为第VA族元素;
(3)第二周期原子中,未成对电子数等于其周期序数即有2个未成对,则p轨道排列2个电子或者4个电子;
解答 解:(1)同周期自左而右,第一电离能增大,在第三周期中,第一电离能最小的元素是Na,周期自左而右,电负性增大,故电负性最大的元素是Cl,
故答案为:Na;Cl;
(2)p轨道最多排6个电子,如果p轨道半满,则p轨道排列3个电子,为第VA族元素,第三周期原子中p轨道半充满的元素是P,故答案为:P;
(3)第二周期原子中,未成对电子数等于其周期序数即有2个未成对,则p轨道排列2个电子或者4个电子,所以第二周期原子中,未成对电子数等于其周期序数的原子有C和O,故答案为:C和O.
点评 本题考查结构性质位置关系应用,涉及元素周期律、核外电子排布规律等,难度不大,推断元素是解题的关键,注意熟练掌握元素周期律与物质性质的递变规律.


科目:高中化学 来源: 题型:解答题
| 水解反应 | 平衡常数(K) |
| Fe3++3H2O?Fe(OH)3+3H+ | 7.9×10-4 |
| Fe2++2H2O?Fe(OH)2+2H+ | 3.2×10-10 |
| Cu2++2H2O?Cu(OH)2+2H+ | 3.2×10-7 |
| 实验内容 | 实验现象 |
| 甲同学的实验方案 | 溶液逐渐变成蓝绿色,pH略有上升 |
| 乙同学的实验方案 | 无明显现象,pH没有明显变化. |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 一定有甲烷 | B. | 一定有乙烷 | C. | 一定无甲烷 | D. | 可能有乙烯 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上月考一化学卷(解析版) 题型:选择题
25℃、101kPa 下:①2Na(s)+1/2O2(g)=Na2O(s) △H1=-414KJ/mol
②2Na(s)+O2(g)=Na2O2(s) △H2=-511KJ/mol
下列说法正确的是
A. ①和②产物的阴阳离子个数比不相等
B. ①和②生成等物质的量的产物,转移电子数不同
C. 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D. 25℃、101kPa 下,Na2O2(s)+2 Na(s)= 2Na2O(s) △H=-317kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
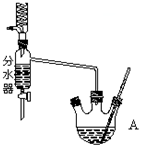 实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表:
实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表:| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解度g/l00g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸钠和金刚石 | B. | 冰和干冰 | C. | 晶体硅和水晶 | D. | 萘和苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(3)(5)(6) | B. | (1)(2)(3)(5) | C. | (1)(2)(4)(5) | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com