
A、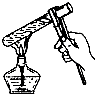 加热试管中的液体 |
B、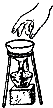 移走蒸发皿 |
C、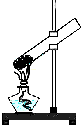 加热结晶水合物 |
D、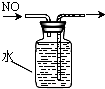 排水集气法收集NO |
| 1 |
| 3 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| V2O |
| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:
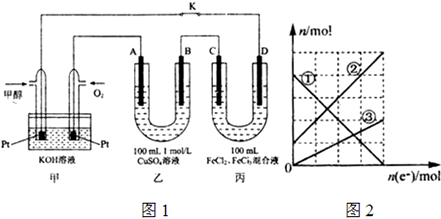
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、食醋用氢氧化钠溶液滴定,开始时溶液的pH通常变化缓慢,当接近滴定终点时,pH 出现突变,称为滴定突跃 |
| B、结晶时,若沉淀的结晶颗粒较大,静置后容易沉降到容器底部,此时,进行分离的操作方法是倾析 |
| C、抽滤装置由布氏漏斗、吸滤瓶、安全瓶、抽气泵等仪器组成,工作的主要原理是抽气泵给吸滤瓶减压,导致装置内部的压强降低,使过滤的速度加快 |
| D、在纸层析法分离Fe3+和Cu2+的实验中,层析后,经氨熏,滤纸中无色带出现,一定是误将试样点浸没在展开剂中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作和现象 | 结论 | |
| A | 向用盐酸酸化的FeCl2溶液的试管中加入少量NaNO2溶液,在管口观察到红棕色气体 | 主要原因是: H++NO2-=HNO2, 2HNO2=NO↑+NO2↑+H2O |
| B | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,没有红色沉淀生成. | 淀粉没有水解成葡萄糖 |
| C | 向阿司匹林(乙酰水杨酸)中加足量饱和NaHCO3溶液,有大量气泡产生. | 阿司匹林彻底水解 |
| D | 向1mL1.0mol?L-1AlCl3溶液中滴加2mL10% NH4F溶液,再滴加1mL 3.0mol?L-1NH3?H2O溶液,无沉淀生成. | Al3+更易与F-结合成AlF63- |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过氧乙酸与羟基乙酸(HOCH2COOH)互为同分异构体 |
| B、过氧乙酸与苯酚混合使用,可增强过氧乙酸杀菌效果 |
C、由下列过氧乙酸的制取原理可以看出,过氧乙酸是酯的同系物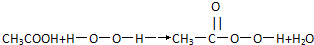 |
| D、浓过氧乙酸溶液中加入少许紫色石蕊试液,振荡后先变红,后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
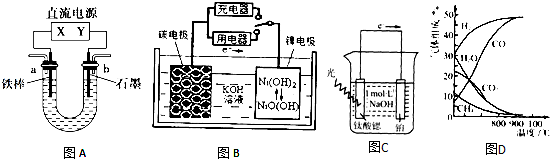
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NO2 |
| B、NO |
| C、N2O |
| D、N2O5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com