
| A. | 100 ml 0.5 mol/L MgCl2 溶液 | B. | 200 ml 0.25 mol/L HCl溶液 | ||
| C. | 50 ml 1 mol/L NaCl溶液 | D. | 200 ml 0.25 mol/L CaCl2溶液 |
分析 100ml 0.5mol/L NaCl中Cl-物质的量浓度为0.5mol/L,结合物质的浓度和构成计算该题.
解答 解:100ml 0.5mol/L NaCl中Cl-物质的量浓度为0.5mol/L,
A.100ml 0.5 mol/L MgCl2 溶液中氯离子的物质的量浓度为0.5 mol/L×2=1mol/L,故A错误;
B.200ml 0.25 mol/L HCl溶液中氯离子的物质的量浓度为0.25 mol/L,故B错误;
C.50ml 1mol/L NaCl溶液中氯离子的物质的量浓度为1mol/L,故C错误.
D.200ml 0.25 mol/L CaCl2溶液中氯离子的物质的量浓度0.25 mol/L×2=0.5mol/L,故D正确;
故选D.
点评 本题考查物质的量浓度的相关计算,为高频考点,注意“溶液中离子的物质的量浓度=溶质的物质的量浓度×化学式中离子的个数进行计算,与溶液的体积无关”,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
 ,有关该化合物的下列说法错误的是( )
,有关该化合物的下列说法错误的是( )| A. | 分子式为C12H18O2 | |
| B. | 分子中至少有6个碳原子共平面 | |
| C. | 该化合物能使酸性高锰酸钾褪色 | |
| D. | 一定条件下,1mol该化合物最多可与3mol H2加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 肼(N2H4)暴露在空气中容易爆炸,但利用其作燃料电池是一种理想的电池,具有容量大、能量转化率高、产物无污染灯特点,其工作原理如图所示,下列叙述正确的是( )
肼(N2H4)暴露在空气中容易爆炸,但利用其作燃料电池是一种理想的电池,具有容量大、能量转化率高、产物无污染灯特点,其工作原理如图所示,下列叙述正确的是( )| A. | 电池工作时,正极附近的pH降低 | |
| B. | 当消耗1molO2时,有2molNa+由甲槽向乙槽迁移 | |
| C. | 负极反应为4OH-+N2H4-4e-=N2↑+4H2O | |
| D. | 若去掉离子交换膜电池也能正常工作 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol羟基 ( 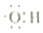 ) 中含有的电子数为0.7NA ) 中含有的电子数为0.7NA | |
| B. | 1 mol Na与O2完全反应,生成Na2O和Na2O2的混合物,转移电子总数为NA | |
| C. | 由1mol CH3COONa和少量CH3COOH形成的中性溶液中,CH3COC-数目为NA | |
| D. | 14g乙烯与丙烯混合气体中的氢原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠、铁和铜一样都能在氯气中燃烧生成金属氯化物 | |
| B. | 硫酸铜溶液中加入足量铝粉,充分振荡溶液颜色将由蓝色变成无色,同时有红色物质析出 | |
| C. | 实现SO2→S的变化需要氧化剂才能实现 | |
| D. | 氯水具有杀菌、漂白作用是因氯水中含有强氧化性的次氯酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
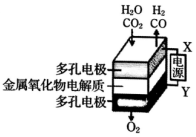 在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )
在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示.下列说法不正确的是( )| A. | 阴极的反应式是:H2O+2e-=H2+O2-、CO2+2e-=CO+O2- | |
| B. | X是电源的负极 | |
| C. | 总反应可表示为:H2O+CO2=H2+CO+O2 | |
| D. | 阴、阳两极生成的气体的物质的量之比是1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入催化剂,平衡常数不变 | |
| B. | 减小容器体积,正、逆反应速率均减小 | |
| C. | 增大C的量,H2O的转化率增大 | |
| D. | 升高温度,平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 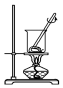 灼烧海带 | B. | 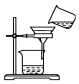 过滤得含I-的溶液 | ||
| C. | 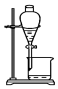 放出碘的苯溶液 | D. | 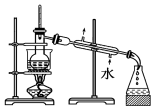 分离碘并回收苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅与NaOH溶液反应:SiO2+2OH-═SiO32-+H2O | |
| B. | 碳酸钡溶于稀盐酸:CO32-+2H+═CO2↑+H2O | |
| C. | 氯气与NaOH溶液反应:Cl2+2OH-═Cl-+ClO-+H2O | |
| D. | 把水玻璃滴入盐酸中:SiO32-+2H+═H2SiO3↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com