
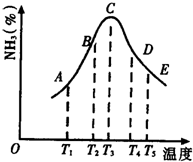
 (1)在容积不同的密闭容器内,分别充入同量的N2和H2,在不同温度下,任其发生反应N2+3H2?2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如图:
(1)在容积不同的密闭容器内,分别充入同量的N2和H2,在不同温度下,任其发生反应N2+3H2?2NH3,并分别在t秒时测定其中NH3的体积分数,绘图如图:分析 (1)①T3之前氨气体积分数增大,说明化学平衡向正反应方向移动,尚未达到化学平衡状态,T3之后,氨气体积分数减小,化学平衡向逆反应方向移动;
②随着温度升高氨气的体积分数减小,据此判断热效应;
③因为反应开始时,正反应速率大于逆反应速率,生成NH3的速度比消耗NH3速度要大,故NH3的体积分数[x(NH3)]不断增加,AC段曲线是增函数;而当达到平衡以后,温度升高、平衡逆向移动,故NH3的体积分数[x(NH3)不断减少,CE段曲线是减函数;
(2)①氢氧化钠在空气中反应生成碳酸钠,溶液pH减小;
②以甲基橙为指示剂,反应后溶液颜色变色范围为3.1~4.4,溶液呈酸性,用酚酞作指示剂,变色范围是8.2~10,溶液呈碱性,以此可确定消耗酸的体积大小关系.
解答 解:(1)①T3之前氨气体积分数增大,说明化学平衡向正反应方向移动,尚未达到化学平衡状态,T3之后,氨气体积分数减小,化学平衡向逆反应方向移动,A、B未达达到化学平衡状态,故答案为:AB;
②氨气的体积分数随着温度升高,而降低,即向逆反应方向移动,说明正反应方向为放热反应,故答案为:放热;
③因为反应开始时,正反应速率大于逆反应速率,生成NH3的速度比消耗NH3速度要大,故NH3的体积分数[x(NH3)]不断增加,AC段曲线是增函数;而当达到平衡以后,温度升高、平衡逆向移动,故NH3的体积分数[x(NH3)不断减少,CE段曲线是减函数,
故答案为:AC段:反应开始v正>v逆,反应向右进行生成NH3.CE段:已达平衡,升温使平衡左移,NH3%变小;
(2)①氢氧化钠在空气中反应生成碳酸钠,溶液pH减小,碳酸钠是强碱弱酸盐,碳酸根离子水解导致溶液呈溶解性,所以pH减小,故答案为:减小;因为NaOH溶液露置于空气中,与空气中二氧化碳反应,使NaOH减少,溶液的pH减小;
②以甲基橙为指示剂,反应后溶液颜色变色范围为3.1~4.4,溶液呈酸性,滴定后溶液溶质为NaCl,则VA=VB,
用酚酞作指示剂,变色范围是8.2~10,溶液呈碱性,在空气中放置一段时间的溶液滴定后溶质为氯化钠和碳酸氢钠,所用酸较少,则VB>VA,
故答案为:VA=VB;VB>VA.
点评 本题考查图象分析及酸碱混合溶液定性判断等知识点,侧重考查学生分析判断能力,(1)中注意曲线变化趋势含义是解本题关键,(2)中注意不同酸碱指示剂对中和滴定的影响,题目难度中等.


 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:解答题
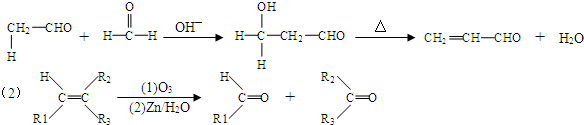
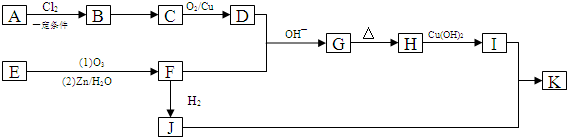
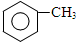 ,B→C的反应类型为:取代反应
,B→C的反应类型为:取代反应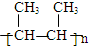
 +O2$→_{△}^{Cu}$ 2
+O2$→_{△}^{Cu}$ 2 +H2O;I+J→K:
+H2O;I+J→K: +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$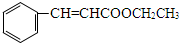 +H2O
+H2O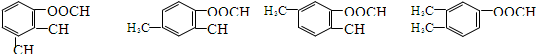 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从CH4、NH4+、SO42-为正四面体结构,可推测PH4+、PO43-也为正四面体结构 | |
| B. | NaCl与CsCl化学式相似,故NaCl与CsCl的晶体结构也相似 | |
| C. | 苯不能使酸性高锰酸钾溶液褪色,故苯的同系物也不能使酸性高锰酸钾溶液褪色 | |
| D. | CO2通入Ca(ClO)2溶液生成CaCO3和HClO,SO2通入Ca(ClO)2溶液也生成CaSO3和HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醛和乙醛 | B. | 丙烯醛和苯甲醛 | C. | 乙酸和甲酸甲酯 | D. | 甲醛和葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO3 HCl AgNO3 BaCl2 | B. | BaCl2 Na2SO3 HCl AgNO3 | ||
| C. | BaCl2 Na2SO3 AgNO3 HCl | D. | AgNO3 HCl BaCl2 Na2SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 金属 | G | L | M | R |
| 和冷水反应 | 无反应 | 慢慢反应 | 未做 | 未做 |
| 和2mol/L HCl 反应 | 溶解并放出气体 | 溶解并放出气体 | 无反应 | 无反应 |
| 和Rn+的水溶液反应 | 溶解并形成沉淀 | 未做 | 溶解并形成沉淀 | 未做 |
| A. | L、G、R、M | B. | G、L、M、R | C. | L、G、M、R | D. | L、R、G、M |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水加热到很高温度都难以分解 | |
| B. | 氨易液化,氨极易溶于水 | |
| C. | CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高 | |
| D. | HF、HCl、HBr、HI的热稳定性依次减弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com