
| A. | 降低了反应的活化能 | B. | 增大了反应物、生成物的能量 | ||
| C. | 降低了反应的焓变 | D. | 增大了反应的平衡常数 |
分析 A.催化剂降低了反应的活化能,增大活化分子百分数;
B.催化剂降低了反应的活化能,增大活化分子百分数,增大活化分子之间的碰撞机会;
C.催化剂改变反应路径,但焓变不变;
D.平衡常数只与温度有关.
解答 解:A.催化剂降低了反应的活化能,增大活化分子百分数,故A正确;
B.催化剂降低了反应的活化能,增大活化分子百分数,增大活化分子之间的碰撞机会,所以反应速率增大,反应物、生成物的能量不受影响,故B错误;
C.催化剂改变反应路径,但焓变不变,故C错误;
D.平衡常数只与温度有关,温度不变,平衡常数不变,与催化剂无关,故D错误;
故选A.
点评 本题考查催化剂对反应速率的影响知识,注意知识的迁移应用是解题的关键,难度中等.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液和CuCl2溶液 | B. | Na2SO4溶液和NaCl溶液 | ||
| C. | AlCl3溶液和NaOH溶液 | D. | 盐酸溶液和Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烷的比例模型是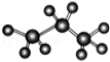 | |
| B. | C2H4 与C3H6一定互为同系物 | |
| C. | 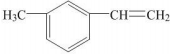 属于芳香烃 属于芳香烃 | |
| D. | 羟基的电子式为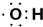 ,1 mol-OH 含有7 mol 电子 ,1 mol-OH 含有7 mol 电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| KCl | K2SO4 | ZnSO4 | ZnCl2 | |
| (1) | 0.3mol | 0.2mol | 0.1mol | ╱ |
| (2) | 0.1mol | 0.3mol | ╱ | 0.1mol |
| A. | 各种离子的浓度均相同 | B. | 只有c(K+)相同 | ||
| C. | 各种离子的浓度均不同 | D. | 只有c(Zn2+)相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
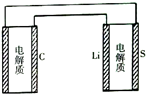 已知:锂离子电池的总反应为:LixC+Li1-xCoO2$?_{充电}^{放电}$C+LiCoO2锂硫电池的总反应为:2Li+S$?_{充电}^{放电}$Li2S有关上述两种电池说法正确的是( )
已知:锂离子电池的总反应为:LixC+Li1-xCoO2$?_{充电}^{放电}$C+LiCoO2锂硫电池的总反应为:2Li+S$?_{充电}^{放电}$Li2S有关上述两种电池说法正确的是( )| A. | 锂离子电池放电时,Li+向负极迁移 | |
| B. | 锂离子电池放电时,负极反应为:6C+xLi++xe-═LixC6 | |
| C. | 理论上两种电池的比能量相同 | |
| D. | 如图表示用锂硫电池给锂离子电池充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图依次为气体制得、除杂并检验其性质的装置(加热及夹持仪器省略).下列设计不能达到目的是( )
如图依次为气体制得、除杂并检验其性质的装置(加热及夹持仪器省略).下列设计不能达到目的是( )| 选项 | 气体 | 装置中药品 | ||
| a | b | C | ||
| A | C2H2 | 饱和食盐水+电石 | CuSO4溶液 | 溴水 |
| B | CO2 | 稀盐酸+石灰石 | 饱和NaHCO3溶液 | 苯酚的溶液 |
| C | C2H4 | 溴乙烷+NaOH乙醇溶液 | 水 | K2Cr2O7酸性溶液 |
| D | SO2 | 碳+浓硫酸 | 新制氯水 | 品红溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制备氢氧化铁胶体:向沸腾的NaOH溶液中,滴加氯化铁饱和溶液,煮沸至红褐色 | |
| B. | 提纯含少量苯酚的苯:加入氢氧化钠溶液,振荡后静置分液,并除去有机相的水 | |
| C. | 检验亚硫酸钠是否变质:将试样溶解后加入氯化钡溶液,观察实验现象 | |
| D. | 比较铁与铜的活泼性:将铜粉加入1.0 mol•L-1 Fe2(SO4)3溶液中,观察实验现象 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com