
| A. | Cu(OH)2浊液中滴加醋酸:Cu(OH)2+2H+═Cu2++2H2O | |
| B. | NaOH溶液中加入铝片:2Al+2 OHˉ═2AlO2ˉ+3H2↑ | |
| C. | 已知Fe2+可以还原C12、Br2,C12可以氧化Br-生成Br2,在标准状况下,向10mL 0.1moL/LFeBr2溶液中通入22.4mL氯气:2Fe2++2Br-+2C12═2Fe3++Br2+4C1- | |
| D. | NaHCO3溶液与稀硫酸溶液的反应:HCO3-+H+═H2O+CO2↑ |
分析 A.醋酸是弱电解质要写化学式;
B.转移电子不守恒、原子不守恒;
C.n(FeBr2)=0.1mol/L×0.01L=0.001mol,n(C12)=$\frac{0.0224L}{22.4L/mol}$=0.001mol,0.001mol亚铁离子被氧化需要0.0005mol,剩余0.0005mol氯气能氧化0.001mol溴离子;
D.碳酸氢钠和稀硫酸反应生成二氧化碳、水.
解答 解:A.醋酸是弱电解质要写化学式,离子方程式为Cu(OH)2+2CH3COOH=Cu2++2CH3COO-+2H2O,故A错误;
B.转移电子不守恒、原子不守恒,离子方程式为2H2O+2Al+2 OHˉ═2AlO2ˉ+3H2↑,故B错误;
C.n(FeBr2)=0.1mol/L×0.01L=0.001mol,n(C12)=$\frac{0.0224L}{22.4L/mol}$=0.001mol,0.001mol亚铁离子被氧化需要0.0005mol,剩余0.0005mol氯气能氧化0.001mol溴离子,所以氯气、溴离子、亚铁离子的物质的量之比为1:1:1,离子方程式为2Fe2++2Br-+2C12═2Fe3++Br2+4C1-,故C正确;
D.碳酸氢钠和稀硫酸反应生成二氧化碳、水,离子方程式为HCO3-+H+═H2O+CO2↑,故D正确;
故选CD.
点评 本题考查离子方程式正误判断,为高频考点,明确离子性质及离子方程式书写规则即可解答,注意要遵循原子守恒、电荷守恒及转移电子守恒,易错选项是C.


科目:高中化学 来源: 题型:填空题
 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醛基的结构简式-COH | B. | 丙烷分子的比例模型为: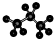 | ||
| C. | 四氯化碳分子的电子式为 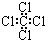 | D. | 2-乙基-1,3-丁二烯的键线式 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
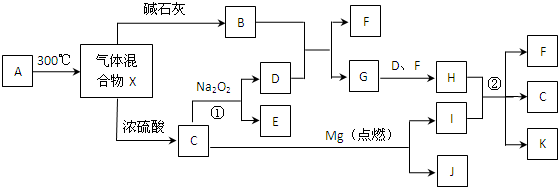
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 二 | ① | ② | ③ | ||||
| 三 | ⑦ | ④ | ⑤ | ⑥ | |||
| 四 | ⑧ | ⑨ | ⑩ |
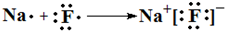 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 具有相同数目的原子 | B. | 都占22.4 L | ||
| C. | 具有相同数目的分子 | D. | 具有相同摩尔质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol | B. | 0.6 mol | C. | 0.7 mol | D. | 0.8 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 黄铜(铜锌合金)制作的铜锣不易生铜锈 | |
| B. | 生铁比软件铁芯(几乎是纯铁)容易生锈 | |
| C. | 纯锌与稀硫酸反应时,滴少量硫酸铜溶液后速率加快 | |
| D. | 银质奖牌久置后表面变暗 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com