
【题目】电解质溶液电导率越大导电能力越强。常温下用0.100mol/L盐酸分别滴定10.00mL浓度均为0.100mol/L的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似,常温下Kb=1.6×10-4)。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法错误的是
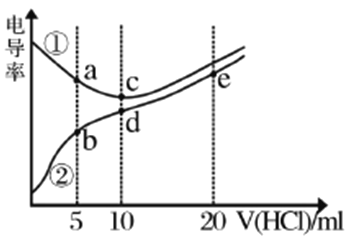
A. a、d、e三点的溶液中,水的电离程度最大的是d点
B. 溶液温度c点高于d点
C. b点溶液中:c[(CH3)2NH2+]+c[(CH3)2NH·H2O]=2c(Cl-)
D. d点溶液中:c(H+)+ c[(CH3)2NH·H2O]=c(OH-)
【答案】D
【解析】(CH3)2NH为弱电解质,在溶液中部分电离,等浓度时离子浓度比NaOH小,则导电性较弱,由此可知②为(CH3)2NH的变化曲线,①为NaOH的变化曲线,加入盐酸(CH3)2NH溶液中离子浓度逐渐增大,导电性逐渐增强,NaOH与盐酸发生中和反应,离子浓度减小,由图象可知加入盐酸10mL时完全反应,A.a点溶质为NaCl和氢氧化钠的混合溶液,氢氧化钠抑制水的电离,d点溶液中溶质为(CH3)2NH2Cl,(CH3)2NH2Cl水解促进水的电离,e点的溶液中溶质为(CH3)2NH2Cl和HCl,HCl抑制水的电离,所以a、d、e三点的溶液中,水的电离程度最大的是d点,故A正确;B.恰好反应时强酸强碱反应放出的热量多,则溶液温度c点高于d点,B正确;C.根据物料守恒b点溶液中:c[(CH3)2NH2+]+c[(CH3)2NH·H2O]=2c(Cl-),C正确;D.d点溶液中,存在质子守恒,即c(H+)=c(OH-)+c[CH3]2NH·H2O],D错误;因此,本题答案选D。


科目:高中化学 来源: 题型:
【题目】一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g),设起始
CO(g)+3H2(g),设起始![]() =Z,在恒压下,平衡时
=Z,在恒压下,平衡时![]() (CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
(CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
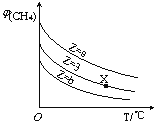
A.该反应的焓变△H>0
B.图中Z的大小为a>3>b
C.图中X点对应的平衡混合物中![]() =3
=3
D.温度不变时,图中X点对应的平衡在加压后![]() (CH4)减小
(CH4)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出符合以下离子方程式的化学方程式:Ba2++SO42-=BaSO4↓________________;
(2)用文字解释明矾净水的原因:______________________________________________;
(3)根据反应8NH3+3Cl2=6NH4Cl+N2,回答下列问题:
①用单线桥表示出该反应电子转移的数目和方向_______________________;
②氧化剂是_____________;
③当有34gNH3参加反应时,被氧化的物质的质量为_____g,生成的还原产物的质量为____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题。
(1)CS2是一种常用的溶剂,CS2的分子中存在________个σ键。在H—S、H—Cl两种共价键中,键的极性较强的是________,键长较长的是________。
(2)氢的氧化物与碳的氧化物中,分子极性较小的是________(填分子式)。
(3)SO2与CO2分子的立体结构分别是________和________,相同条件下两者在水中的溶解度较大的是______(写分子式),理由是____________________________。
(4)醋酸的球棍模型如图1所示。
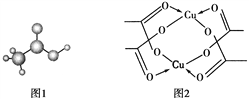
①在醋酸中,碳原子的轨道杂化类型有________;
②Cu的水合醋酸盐晶体局部结构如图2所示,该晶体中含有的化学键是________(填选项字母)。
A.极性键 B.非极性键 C.配位键 D.金属键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下列模型并结合有关信息,判断下列说法不正确的是( )
HCN | S8 | SF6 | B12结构单元 | |
结构模型 示意图 |
|
|
|
|
备注 | — | 易溶于CS2 | — | 熔点1 873 K |
A. HCN的结构式为H—C≡N,分子中含有2个σ键和2个π键
B. 固态硫S8属于原子晶体
C. SF6是由极性键构成的非极性分子
D. 单质硼属原子晶体,结构单元中含有30个B—B键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒(23V)是我国的丰产元素,广泛用于催化及钢铁工业。回答下列问题:
(1)钒在元素周期表中的位置为_______,其价层电子排布图为____________。
(2)钒的某种氧化物的晶胞结构如图1所示。晶胞中实际拥有的阴、阳离子个数分别为____、_____。
(3)V2O5常用作SO2转化为SO3的催化剂。SO2分子中S原子价层电子对数是__对,分子的立体构型为___;SO3气态为单分子,该分子中S原子的杂化轨道类型为____;SO3的三聚体环状结构如图2所示,该结构中S原子的杂化轨道类型为___;该结构中S—O键长有两类,一类键长约140pm,另一类键长约为160pm,较短的键为__(填图2中字母),该分子中含有___个σ键。

(4)V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子的立体构型为___;也可以得到偏钒酸钠,其阴离子呈如图3所示的无限链状结构,则偏钒酸钠的化学式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置探究铁粉在高温下与水蒸气反应的实验。
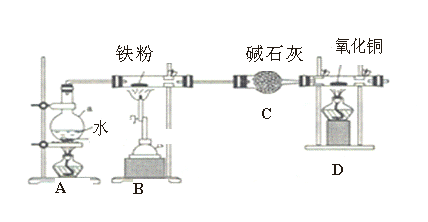
(1)A装置加热作用是___________________________;
(2)B中反应的化学方程式:_________________________________________,标准状况下,若该反应生成22.4L气体,则反应转移的电子数为______________。
(3)装置D中的现象是___________________,写出D中反应方程式:_________________。
(4)A 、B两处酒精灯点燃顺序:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10mL 0.1mol·L1NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的是
A.x=10时,溶液中有NH4+、Al3+、SO42-,且c(NH4+)=c(SO42-) >c(Al3+)
B.x=15时,溶液中有NH4+、SO42-,且c(NH4+)<2c(SO42-)
C.x=20时,溶液中有NH4+、Al3+、OH-,且c(OH-)<c(Al3+)
D.x=30时,溶液中有Ba2+、AlO2-、OH-,且c(OH-) = c(Ba2+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO、NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)与氮氧化物有关的全球或区域性大气环境问题有_______(填字母序号)。
a.酸雨 b.沙尘暴 c.光化学烟雾 d.白色污染
(2)NO2可与水发生反应,反应的化学方程式为__________________。若该反应有0.6NA个电子转移,则参加反应的NO2的物质的量为___________。
(3)NH3也是重要的含氮化合物,请写出实验室中由固体物质制取氨气的化学方程式________________________________;工业上可利用NH3经过一系列反应制取硝酸,请写出NH3在催化剂的作用下,与O2反应的化学方程式_________________________________。
(4)硝酸可与不活泼金属铜发生反应。将过量的铜置入一定量的浓硝酸中,微热,充分反应后,放出1.12 L气体(标准状况下),
①写出反应过程其中1个化学反应的化学方程式:_______________________________。
②整个反应过程中,被还原的HNO3总的物质的量是___________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com