
| A. | 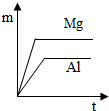 | B. |  | C. | 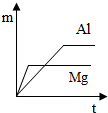 | D. |  |
分析 根据金属的活动性镁>铝,镁与稀硫酸反应比铝剧烈,相同时间内镁与稀硫酸反应放出氢气质量大于铝;
根据金属与足量稀硫酸反应放出氢气的质量=$\frac{金属化合价}{金属的相对原子质量}$×金属质量,等质量的镁片和铝片与足量稀硫酸反应,所放出氢气的质量大小取决于两金属的化合价与相对原子质量的比;据此可判断等质量铝完全反应放出氢气质量大量镁片.
解答 解:由于金属镁的活动性大于铝,在相同时间内镁片所放出氢气的质量大于铝片;据此可判断图D错误;
假设两种金属的质量为m,则与足量稀硫酸完全反应放出氢气的质量分别为:
镁完全反应产生氢气的质量=$\frac{2}{24}$m=$\frac{1}{12}$m;
铝完全反应产生氢气的质量=$\frac{3}{27}$×m=$\frac{1}{9}$m.
因为$\frac{1}{12}$m<$\frac{1}{9}$m,所以等质量镁与硫酸完全反应所产生氢气质量小于铝;据此可判断图C正确;
故选C.
点评 根据金属活动性可判断金属与酸反应的剧烈程度;根据金属与足量酸完全反应放出氢气质量可判断,等质量的金属完全反应放出氢气质量的大小;此类问题多由这两个方面进行判断.


 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:解答题
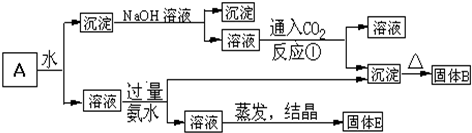
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向等物质的量浓度的NaOH和Na2CO3的混合液中加入一定量的稀盐酸:2OH-+CO32-+4H+═CO2↑+2H2O | |
| B. | Ca(HCO3)2溶液中滴加少量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- | |
| C. | 向Fe(OH)2中加入稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O | |
| D. | 向AlCl3溶液中滴加过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢化物的沸点Y>R>X | B. | 含氧酸酸性R>X | ||
| C. | X、Y不可能共存于离子化合物中 | D. | 原子半径Z>R>X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
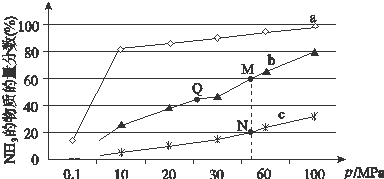
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钙溶液中通入CO2气体 Ca2++CO2+H2O═CaCO3↓+2H+ | |
| B. | 以石墨作电极电解氯化铝溶液:2Cl${\;}^{_}$+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| C. | Ca(ClO)2溶液中通人过量的SO2气体:Cl-+SO2+H2O═HClO+HSO${\;}_{3}^{-}$ | |
| D. | 向明矾溶液中加入氢氧化钡溶液至沉淀的质量最大:Al3++2SO${\;}_{4}^{2-}$+2Ba2++4OH-═2BaSO4+AlO${\;}_{2}^{-}$+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1-氯丙烷中加NaOH溶液后加热:CH3CH2CH2Cl+NaOH$→_{△}^{水}$CH3CH=CH2↑+NaCl+H2O | |
| B. | 将少量二氧化硫通入次氯酸钠溶液中:SO2+H2O+ClO-═SO42-+Cl-+2H+ | |
| C. | NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-═NH3•H2O | |
| D. | 用过量的氨水吸收烟道气中的SO2:SO2+2NH3•H2O═2NH4++SO32-+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com