
| 编号 | 实验操作 | 实验现象 |
| ① | 取少量黑色粉末X放入试管1中,注入浓盐酸,微热 | 黑色粉末逐渐溶解,溶液呈黄绿色;有气泡产生 |
| ② | 向试管1中滴加几滴KSCN溶液,振荡 | 溶液出现血红色 |
| ③ | 另取少量黑色粉末X放入试管2中,注入足量硫酸铜溶液,振荡,静置 | 有极少量红色物质析出,仍有较多黑色固体未溶解 |
分析 I.(1)极少量红色物质为铜,该反应为铁粉和硫酸铜反应生成铜和硫酸亚铁,发生了金属的置换反应.
(2)通过①③可判断Fe的存在.再通过Ⅰ可知黑色粉末为铁与Fe3O4.
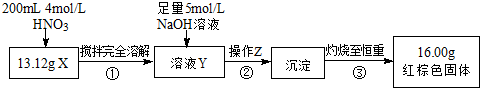
Ⅱ.(1)通过加硝酸溶解和足量的氢氧化钠溶液,生成了氢氧化铁沉淀,因此操作Z为过滤;
(2)红棕色固体为氧化铁,根据铁原子物质的量守恒和Fe3O4和Fe的质量为13.12g列式计算;
(3)溶液Y中铁离子的物质的量为0.2mol,带入c=$\frac{n}{V}$计算.
解答 解:I.(1)极少量红色物质为铜,该反应为铁粉和硫酸铜反应生成铜和硫酸亚铁,发生了金属的置换反应,离子方程式为Fe+Cu2+=Fe2++Cu,
故答案为:Fe+Cu2+=Fe2++Cu;
(2)铁能和盐酸反应生成气体,且铁和铜离子发生置换反应生成红色的铜,据此现象判断存在铁;Fe3+能使KSCN溶液呈现血红色,这是Fe3+的特征反应,据此判断Fe3O4的存在.故黑色粉末X为Fe3O4和Fe的混合物.
故答案为:Fe3O4和Fe的混合物;
Ⅱ.(1)通过加硝酸溶解和足量的氢氧化钠溶液,生成了氢氧化铁沉淀,因此操作Z为过滤,
故答案为:过滤;
(2)红棕色固体为氧化铁,16g氧化铁中含有铁原子的物质的量为$\frac{16g}{160g/mol}$×2=0.2mol,设13.12g混合固体中铁的物质的量为xmol,Fe3O4的物质的量为ymol,则
①x+3y=0.2mol②56x+232y=13.12 两式联立求得x=0.11mol,y=0.03mol,
故答案为:Fe:0.11mol、Fe3O4:0.03mol;
(3)通过(2)中计算可知铁离子的物质的量为0.2mol,因此c(Fe3+)=$\frac{0.2mol}{0.2L}$=1mol/L,
故答案为:1.
点评 本题考查了铁及其重要化合物的性质,涉及化学实验基本操作、物质的量的计算等基本原理以及定量计算测定等,对知识综合运用,考查思维能力,难度中等.


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液与单质铜反应:2Fe3++3Cu═2Fe+3Cu2+ | |
| B. | Ba(OH)2溶液与盐酸反应:H++OH-═H2O | |
| C. | AlCl3溶液加入过量氨水:Al3++4OH-═AlO2-+2H2O | |
| D. | Na2O与水混合生成烧碱:O2-+H2O═2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10s时,再加入一定量的D,平衡向右移动 | |
| B. | 10s时用D物质表示的速率为0.04mol/(L•S) | |
| C. | 10s时,容器中B的浓度为1.6mol•L-1 | |
| D. | 达到平衡时A的转化率为60%,若要在相同条件下反应达到平衡时A的转化率仍为60%,起始加入n(A)=n(B)即可 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌片是正极,铜片上有气泡冒出 | B. | 电流方向是从锌片流向铜片 | ||
| C. | 溶液中硫酸的物质的量不断减小 | D. | 电解液的pH保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮及其化合物在很多方面有重要的用途.
氮及其化合物在很多方面有重要的用途.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯乙烷与氢氧化钠醇溶液共热:C2H5Cl+OH-$\stackrel{△}{→}$C2H5OH+Cl- | |
| B. | 溴乙酸与热氢氧化钠溶液反应:BrCH2COOH+OH-=BrCH2COO-+H2O | |
| C. | 苯酚钠溶液中通入少量CO2:2C6H5O-+H2O+CO2→2C6H5OH+CO32- | |
| D. | 乙醛与氢氧化铜碱性悬浊液共热: CH3CHO+2Cu(OH)2+OH-$\stackrel{△}{→}$CH3COO-+Cu2O↓+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:W>Y>Z | |
| B. | X、Y与Z形成的化合物中既有极性共价键又有离子键 | |
| C. | Z与Y形成的化合物为一种高温结构陶瓷 | |
| D. | X与Y只能形成10电子分子,不能形成18电子分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com