
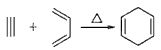 ,如果要合成
,如果要合成 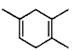 所用的原始原料可以是__________
所用的原始原料可以是__________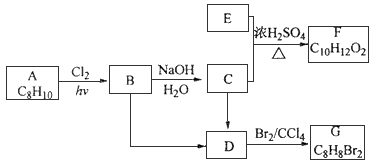
科目:高中化学 来源: 题型:
 硫一碘循环分解水制氢主要涉及下列反应:
硫一碘循环分解水制氢主要涉及下列反应:查看答案和解析>>
科目:高中化学 来源: 题型:
某化学研究性学习小组为探究某品牌花生油中不饱和脂肪酸的含量,进行了如下实验:
步骤I:称取0.4 g花生油样品,置于两个干燥的碘瓶(如图)内,加入10 mL四氯化碳,轻轻摇动
使油全部溶解。向碘瓶中加入25.00 mL含0.01 molIBr的无水乙酸溶液,盖好瓶塞,在玻璃塞与瓶口之间滴加数滴10%碘化钾溶液封闭缝隙,以免IBr的挥发损失。
步骤II:在暗处放置30 min,并不时轻轻摇动。30 min后,小心地打开玻璃塞,用新配制的10%
碘化钾10 mL和蒸馏水50 mL把玻璃塞和瓶颈上的液体冲洗入瓶内。
步骤Ⅲ:加入指示剂,用0.1 mol·L-1硫代硫酸钠溶液滴定,用力振荡碘瓶,直至终点。
测定过程中发生的相关反应如下:
① ②IBr+KI=I2+KBr ③ I2+2S2O32-=2I-+S4O62-
请回答下列问题:
(1)已知卤素互化物IBr的性质与卤素单质类似,实验中准确量取IBr溶液应选用的仪器是 ,碘瓶不干燥会发生反应的化学方程式 。
(2)步骤Ⅱ中碘瓶在暗处放置30 min,并不时轻轻摇动的原因是 。
(3)步骤Ⅲ中所加指示剂为 ,滴定终点的现象 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年四川省南充市高三第二次诊断性考试(理综)化学部分 题型:填空题
工业合成氨与制备硝酸一般可连续生产,流程如图17所示:

请回答下列问题:
I.合成氨
(1)已知在一定的温度下进入装置①的氮、氢混合气体(按理论计量比混合)与从装置①出来的混合气体压强之比为5: 4,则氮气的转化率为________________________。
II.氨的接触氧化原理
已知1 :在9000C时,装置②中反应有:

除了上列反应外,氨和一氧化氮相互作用:
 ;
; ,还可能发生氨、一氧化氮的分解。
,还可能发生氨、一氧化氮的分解。
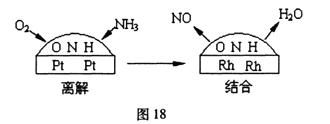
已知2:铂一铭合金催化剂的催化机理为离解和结合两过程,如图18所示:由于铂对NO和水分子的吸附力较小,有利于氮与氧原子结合,使得NO和水分子在铂表面脱附,进入气相中。请回答第(2) (3)小题:

(2)完成热化学方程式: ;
; =________________。
=________________。
(3)若没有使用钼一铑合金催化剂,氨氧化结果将主要生成________。说明催化剂对反应有________
(4)温度对一氧化氮产率的影响(图19)

当温度大于900¾时,NO的产率下降的原因________________________(选填序号)。
A.促进了一氧化氮的分解 B.促进了氨的分解
C.使氨和一氧化氮的反应平衡移动,生成更多N2
查看答案和解析>>
科目:高中化学 来源: 题型:
工业合成氨与制备硝酸一般可连续生产,流程如图17所示:

请回答下列问题:
I.合成氨
(1)已知在一定的温度下进入装置①的氮、氢混合气体(按理论计量比混合)与从装置①出来的混合气体压强之比为5: 4,则氮气的转化率为________________________。
II.氨的接触氧化原理
已知1 :在9000C时,装置②中反应有:
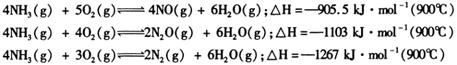
除了上列反应外,氨和一氧化氮相互作用:
![]() ;
;![]() ,还可能发生氨、一氧化氮的分解。
,还可能发生氨、一氧化氮的分解。
已知2:铂一铭合金催化剂的催化机理为离解和结合两过程,如图18所示:由于铂对NO和水分子的吸附力较小,有利于氮与氧原子结合,使得NO和水分子在铂表面脱附,进入气相中。请回答第(2) (3)小题:
(2)完成热化学方程式:![]() ;
;![]() =________________。
=________________。
(3)若没有使用钼一铑合金催化剂,氨氧化结果将主要生成________。说明催化剂对反应有________
(4)温度对一氧化氮产率的影响(图19)

当温度大于900??时,NO的产率下降的原因________________________(选填序号)。
A.促进了一氧化氮的分解 B.促进了氨的分解
C.使氨和一氧化氮的反应平衡移动,生成更多N2
查看答案和解析>>
科目:高中化学 来源: 题型:
工业合成氨与制备硝酸一般可连续生产,流程如图17所示:
请回答下列问题:
I.合成氨
(1)已知在一定的温度下进入装置①的氮、氢混合气体(按理论计量比混合)与从装置①出来的混合气体压强之比为5: 4,则氮气的转化率为________________________。
II.氨的接触氧化原理
已知1 :在9000C时,装置②中反应有:
除了上列反应外,氨和一氧化氮相互作用:
;
,还可能发生氨、一氧化氮的分解。
已知2:铂一铭合金催化剂的催化机理为离解和结合两过程,如图18所示:由于铂对NO和水分子的吸附力较小,有利于氮与氧原子结合,使得NO和水分子在铂表面脱附,进入气相中。请回答第(2) (3)小题:
(2)完成热化学方程式:;
=________________。
(3)若没有使用钼一铑合金催化剂,氨氧化结果将主要生成________。说明催化剂对反应有________
(4)温度对一氧化氮产率的影响(图19)
当温度大于900¾时,NO的产率下降的原因________________________(选填序号)。
A.促进了一氧化氮的分解 B.促进了氨的分解
C.使氨和一氧化氮的反应平衡移动,生成更多N2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com