
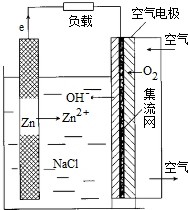
| A. | 放电时,电池正极反应式为:O2+H++4e-=2H2O | |
| B. | 增大空气进气口直径,可增大电池输出能力并延长电池使用寿命 | |
| C. | 放电时,每通入2.24L空气(标准状况),理论上负极需要消耗13gZn | |
| D. | 电池用完后,只需更换封装好的锌粉或电池锌板即可 |
分析 A、放电时,正极发生还原反应,电解质溶液中无氢离子,电极反应式为:O2+2H2O+4e-=4OH-;
B、增大空气进气口直径,可增大电池输出能力,但缩短了电池的寿命;
C、每通入2.24L空气(标准状况),所以氧气的物质的量为:0.1×$\frac{1}{5}$=0.02mol,则转移电子的物质的量为:0.04mol,参加反应的锌为0.02mol;
D、因为负极锌失去电子变成锌离子,所以只要补充负极材料即可.
解答 解:A、放电时,正极发生还原反应,电极反应式为:O2+2H2O+4e-=4OH-,故A错误;
B、增大空气进气口直径,可增大电池输出能力,锌的消耗速度加快,所以缩短了电池的寿命,故B错误;
C、每通入2.24L空气(标准状况),所以氧气的物质的量为:0.1×$\frac{1}{5}$=0.02mol,则转移电子的物质的量为:0.04mol,参加反应的锌为0.02mol,所以参加反应的锌为0.02mol×65g/mol=1.3g,故C错误;
D、因为负极锌失去电子变成锌离子,所以只要补充负极材料即可,故D正确;
故选D.
点评 本题考查了原电池的反应原理和电极反应方程式的书写,相关计算学生要抓住电子守恒分析解答,比较容易.


科目:高中化学 来源: 题型:解答题
 氨气是一种重要的化工产品,是生产铵盐、尿素等的原料.现有如下两种合成氨的途径:
氨气是一种重要的化工产品,是生产铵盐、尿素等的原料.现有如下两种合成氨的途径:| 时间/min | 0 | 30 | 70 | 80 | 100 |
| n(CO2)/mol | 0.10 | 0.060 | 0.040 | 0.040 | 0.040 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在一定温度下,向容积为2L的密闭容器中加入1mol A和2mol B,发生如下反应:A(g)+2B(g)?2C(g)△H,经5min达到平衡时,生成0.4mol C,下列叙述中正确的是( )
在一定温度下,向容积为2L的密闭容器中加入1mol A和2mol B,发生如下反应:A(g)+2B(g)?2C(g)△H,经5min达到平衡时,生成0.4mol C,下列叙述中正确的是( )| A. | 反应的平均速率v(A)=0.04 mol/(L•min) | |
| B. | 达平衡时A、B的转化率相等 | |
| C. | 向平衡混合物中再加入0.1 mol A、0.2 mol B,达新平衡时C的体积分数减小 | |
| D. | 若升高温度达新平衡后,A的浓度增大,则△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸乙基铵水溶液呈碱性 | |
| B. | 该离子液体可以作为电池的电解质 | |
| C. | (C2H5NH3)NO3能与氢氧化钠反应产生NH3 | |
| D. | 相同温度下,相同物质的量的浓度的硝酸乙基铵溶液和硝酸铵溶液相比前者的pH小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2或SO2都会导致酸雨的形成 | |
| B. | 垃圾是放错地方的资源,应分类回收利用 | |
| C. | 纤维素在人体内可水解为葡萄糖,故可作人类的营养物质 | |
| D. | 葡萄中的花青素在碱性环境下显蓝色,故可用苏打粉检验假红酒 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com