
| 实验序号 | 消耗0.1032mol•L-1的氢氧化钠溶液的体积/mL | 待测盐酸溶液的体积/mL |
| 1 | 28.84 | 25.00 |
| 2 | 27.83 | 25.00 |
| 3 | 27.85 | 25.00 |
分析 (1)根据中和滴定有检漏、洗涤、润洗、装液、取待测液并加指示剂、滴定等操作;
(2)先根据数据的有效性,然后求出平均消耗V(氢氧化钠),再根据反应HCl+NaOH═NaCl+H2O求出c(盐酸);
(3)如溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(4)根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对V(标准)的影响,以此判断浓度的误差;
(5)若用同浓度的氨水与同浓度的盐酸混合至二者恰好完全中和,得氯化铵溶液,据此确定溶液中各离子的物质的量浓度由大到小的顺序.
解答 解:(1)中和滴定按照检漏、洗涤、润洗、装液、取待测液并加指示剂、滴定等顺序操作,则正确的顺序为:BDCEAF;
故答案为:BDCEAF;
(2)三次滴定消耗氢氧化钠溶液的体积为:28.84mL,27.83mL,27.85mL,第1组数据无效,则平均消耗V(氢氧化钠)=27.84mL,
HCl+NaOH═NaCl+H2O
25.00ml×c(盐酸) 27.84mL×0.1032mol•L-1
解得:c(盐酸)=0.1149mol•L-1
故答案为:0.1149;
(3)用标准NaOH溶液滴定盐酸溶液,用酚酞作指示剂,所以终点时,当滴入最后一滴氢氧化钠溶液后,溶液由无色变为浅红色,且在半分钟内不褪色,
故答案为:溶液由无色变为浅红色,且半分钟内不褪色;
(4)A、酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,测定c(待测)偏大,故A错误;
B、滴定前盛放盐酸的锥形瓶用蒸馏水洗净后没有干燥,待测液的物质的量不变,对V(标准)无影响,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,测定c(待测)无影响,故B错误;
C、碱式滴定管在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,测定c(待测)偏大,故C错误;
D、读取氢氧化钠溶液体积时,开始仰视读数,滴定结束时俯视读数,造成V(标准)偏小,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,测定c(待测)偏低,故D正确;
故答案为:D;
(5)若用同浓度的氨水与同浓度的盐酸混合至二者恰好完全中和,得氯化铵溶液,溶液中各离子的物质的量浓度由大到小的顺序是:(Cl-)>c(NH4+)>c(H+)>c(OH-);
故答案为:(Cl-)>c(NH4+)>c(H+)>c(OH-).
点评 本题主要考查酸、碱滴定实验的基本操作,侧重于学生的分析能力和实验能力的考查,难度不大,学生应注意操作的规范性和实验中常见的误差分析.


科目:高中化学 来源: 题型:选择题
| A. | 乙烯使酸性高锰酸钾溶液褪色 | |
| B. | 氢气和氯气光照下生成氯化氢 | |
| C. | 乙炔和氢气在催化剂下合成乙烷 | |
| D. | 乙烷和氯气光照下生成多氯代物和氯化氢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,相同浓度的CH3COOH与NH3•H20的电离程度相同 | |
| B. | 温度改变后,Ka、Kb都会发生改变 | |
| C. | 室温下,CH3COOH溶液中的[H+]与NH3•H2O中的[OH-]相等 | |
| D. | 室温下,相同物质的量浓度时,CH3COOH溶液中的[H+]与NH3•H2O中的[OH-]相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油是多种烃的混合物,只含碳、氢两种元素 | |
| B. | 石油分馏得到的各馏分为纯净物 | |
| C. | 石油裂解的主要目的是为了提高汽油的产量 | |
| D. | 裂化汽油中含烯烃,不易作卤素单质的萃取剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 序号 | 金属 质量/g | 金属 状态 | c(H2SO4) mol/L | V(H2SO4) mL | 溶液温度/℃ | 金属消失 的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.7 | 50 | 20 | 35 | 250 |
| 2 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 3 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 4 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.60 | 20.50 |
| 第二次 | 10.00 | 3.00 | 23.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
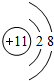
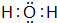 、
、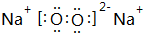 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com