
【题目】硫化氢是一种急性剧毒气体,回收硫化氢解决了环境污染问题也可变废为宝。其反应原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l) △H=-632 kJ·mol-1。在酸性固体电解质环境下,硫化氢的处理原理图如图所示。下列说法正确的是

A.电极a的电极反应式为2H2S-4e-=S2+4H+
B.电子由电极a经质子固体电解质膜流向电极b
C.1 mol的H2S气体完全反应得到固体S2和水蒸气放热316kJ
D.负载中电流的方向自上而下
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某溶液X中可能含有下列离子中的若干种:NH4+、Na+、Ba2+、Fe3+、I-、SO32-、SO42-为了确定该溶液的组成,某同学取上述溶液X,进行了如下实验:
(1)向一定量溶液X加入少量氯水,然后滴加淀粉溶液,未显蓝色;
(2)另取100毫升溶液X再加入足量氯水,然后滴加足量BaCl2溶液,得到沉淀6.99g;
(3)将上述(2)的反应混合液过滤,在滤液中加足量NaOH溶液并加热,生成的气体在标准状况下体积为2.24L。
根据上述实验,以下推测正确的是
A.原溶液可能存在Na +、Fe3+、SO42-
B.原溶液一定存在NH4+、I-
C.原溶液一定不含Ba2+、Fe3+、I-
D.另取X试液滴加足量盐酸酸化的BaCl2溶液,即可确定溶液所有的离子组成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是( )
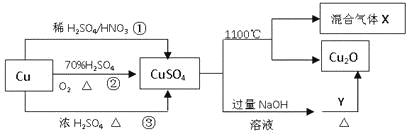
A.途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2
B.相对于途径①、③,途径②更好地体现了绿色化学思想
C.1molCuSO4在1100℃所得混合气体X中O2可能为0.75mol
D.Y可以是葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤代烯烃是合成塑料的重要原料,研究合成卤代烯烃具有重要意义。T℃时,在10 L的密闭容器中充入1mol 2-丁炔(CH3-C≡C-CH3,可用X表示)和1molHCl,以Al2O3为催化剂发生如下反应:
Ⅰ.CH3-C≡C-CH3(g)+HCl(g)![]()
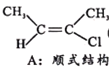 (g) H=akJ/mol(a<0)
(g) H=akJ/mol(a<0)
Ⅱ.CH3-C≡C-CH3(g)+HCl(g)![]()
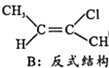 (g) H=bkJ/mol(a<0)
(g) H=bkJ/mol(a<0)
已知B比A更稳定,且产物A、B在混合物中的物质的量随时间变化如图所示。试回答下列问题。

(1)发生反应I、Ⅱ的同时,还有反应A转化为B,且焓变为△H'。则△H' ___0(填“>”、“<”或“=”)。
(2)①从反应开始至20 min时生成B的平均速率v(B)=____;
②反应至20 min时CH3-C≡C-CH3的转化率=____;
③在T℃时,反应I的平衡常数为____。
(3)T℃时,E1和E2分别代表反应I,Ⅱ的正反应活化能。
①由图得出:E1___E2(填“>”、“<”或“=”);
②试从反应方向的角度分析,20 min后A的物质的量减小的原因____
(4)其它条件相同时,测出生成A、B 的速率随温度变化如图所示,则提高B在较低温度下产率的措施是______

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论不正确的是

A. 图甲是CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
B. 图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小
C. 图丙是室温下用0.1000 mol·L1NaOH溶液滴定20.00 mL 0.1000 mol·L1某一元酸HX的滴定曲线,说明HX是一元强酸
D. 图丁是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+ )与c(SO42)的关系曲线,说明溶液中c(SO42 )越大c(Ba2+ )越小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol X气体跟a mol Y气体在体积可变的密闭容器中发生如下反应:X(g) + aY(g)![]() bZ(g),反应达到平衡后,测得X的转化率为50% 。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是
bZ(g),反应达到平衡后,测得X的转化率为50% 。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是
A. a=l,b=2 B. a=2,b=1 C. a=2,b=2 D. a=3,b=2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组研究NaClO溶液与KI溶液的反应,实验记录如下:
实验编号 | 实验操作 | 实验现象 |
Ⅰ |
| ⅰ.溶液变为浅黄色 ⅱ.溶液变蓝 |
Ⅱ |
| ⅰ.溶液保持无色 ⅱ.溶液不变蓝,溶液的pH=10 |
【资料】:碘的化合物主要以I和IO3的形式存在。酸性条件下IO3不能氧化Cl,可以氧化I。ClO在pH<4并加热的条件下极不稳定。
(1)0.5 mol·L1 NaClO溶液的pH=11,用离子方程式表示其原因:______。
(2)实验Ⅰ中溶液变为浅黄色的离子方程式是______。
(3)对比实验Ⅰ和Ⅱ,研究实验Ⅱ反应后“溶液不变蓝”的原因。
① 提出假设a:I2在碱性溶液中不能存在。设计实验Ⅲ证实了假设a成立,实验Ⅲ的操作及现象是______。
② 进一步提出假设b:NaClO可将I2氧化为IO3。进行实验证实了假设b成立,装置如下图,其中甲溶液是______,实验现象是______。

(4)检验实验Ⅱ所得溶液中的IO3:
取实验Ⅱ所得溶液,滴加稀硫酸至过量,整个过程均未出现蓝色,一段时间后有黄绿色刺激性气味的气体产生,测得溶液的pH=2。再加入KI溶液,溶液变蓝,说明实验Ⅱ所得溶液中存在IO3。
① 产生的黄绿色气体是______。
② 有同学认为此实验不能说明实验Ⅱ所得溶液中存在IO3,理由是______。欲证明实验Ⅱ所得溶液中存在IO3,改进的实验方案是______。
③ 实验Ⅱ中反应的离子方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可利用环己醇的氧化反应制备环己酮,反应原理和实验装置(部分夹持装置略)如下:

有关物质的物理性质见下表。
物质 | 沸点(℃) | 密度(g·cm-3,20℃) | 溶解性 |
环己醇 | 161.1(97.8)* | 0.96 | 能溶于水和醚 |
环己酮 | 155.6(95.0)* | 0.95 | 微溶于水,能溶于醚 |
水 | 100.0 | 1.0 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点。
实验中通过装置B将酸性Na2Cr2O7溶液加到盛有10 mL环己醇的A中,在55 ~ 60℃进行反应。反应完成后,加入适量水,蒸馏,收集95 ~ 100℃的馏分,得到主要含环己酮粗品和水的混合物。
(1)装置D的名称为____________________________。
(2)酸性Na2Cr2O7溶液氧化环己醇反应的![]() ,反应剧烈将导致体系温度迅速上升,副反应增多。
,反应剧烈将导致体系温度迅速上升,副反应增多。
①滴加酸性Na2Cr2O7溶液的操作为____________________________________________;
②蒸馏不能分离环己酮和水的原因是__________________________________________。
(3)环己酮的提纯需要经过以下一系列的操作:
a.蒸馏、除去乙醚后,收集151~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加人无水MgSO4固体,除去有机物中少量的水
①上述提纯步骤的正确顺序是________________________________________________;
②B中水层用乙醚萃取的目的是______________________________________________;
③上述操作c、d中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需要的玻璃仪器有__________,操作d中,加入NaC1固体的作用是_____________________________。
(4)恢复至室温时,分离得到纯产品体积为6 mL,则环已酮的产率为____________。(计算结果精确到0.1%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】马里诺娃博士找到了一种比二氧化碳有效![]() 倍的“超级温室气体”全氟丙烷
倍的“超级温室气体”全氟丙烷![]() ,并提出用其“温室化火星”使其成为第二个地球的计划。有关全氟丙烷的说法正确的是( )
,并提出用其“温室化火星”使其成为第二个地球的计划。有关全氟丙烷的说法正确的是( )
A.分子中三个碳原子可能处于同一直线上
B.相同压强下,沸点:![]()
C.全氟丙烷的电子式为:![]()
D.全氟丙烷中既有极性键又有非极性键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com