
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:选择题
| 橱名 | 甲 | 乙 | 丙 | 丁 |
| 试剂 | 盐酸、硝酸 | 烧 碱、苛性钾 | 食盐、氯化钡 | 酒精、汽油 |
| A. | 甲橱 | B. | 乙橱 | C. | 丙橱 | D. | 丁橱 |
查看答案和解析>>
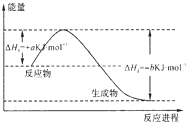
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,该反应的热化学方程式是 NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=+57.4 kJ•mol-1 | |
| B. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石一定比石墨稳定 | |
| C. | 已知2H2O(g)═2H2(g)+O2(g)△H=+483.6 kJ•mol-1,则提供483.6 kJ热量时,一定会使2 mol H2O (g)发生分解 | |
| D. | 已知C(s)+O2(g)=CO2(g)△H=a kJ•mol-1,2C(s)+O2(g)═2CO(g),△H=b kJ•mol-1,则2CO(g)+O2(g)═2CO2(g)△H=(2a-b) kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂能使化学反应速率加快,平衡常数增大 | |
| B. | 平衡常数随温度的改变而改变 | |
| C. | 化学平衡发生移动,平衡常数必发生变化 | |
| D. | 对于3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g),反应的化学平衡常数的表达式为K=$\frac{c(F{e}_{3}{O}_{4})•{c}^{4}({H}_{2})}{c(Fe)•{c}^{4}({H}_{2}O)}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c(HX)>c(X-) | B. | c(HX)+c(H+)=c(Na+)+c(OH-) | ||
| C. | c(X-)+c(HX)=2c(Na+) | D. | c(OH-)<c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol CO+1.5 mol H2O(g)+0.4 mol CO2+0.4 mol H2 | |
| B. | 0.5 mol CO+2 mol H2O(g)+1 mol CO2+1 mol H2 | |
| C. | 0.5 mol CO+1.5 mol H2O(g)+0.5 mol CO2+0.5 mol H2 | |
| D. | 1 mol CO+1 mol H2O(g)+1 mol CO2+1 mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液、萃取、蒸馏 | B. | 萃取、蒸馏、分液 | C. | 分液、蒸馏、萃取 | D. | 蒸馏、萃取、分液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com