
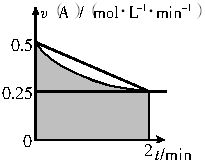
ij��Һ�з�����ӦA 2B+C��A�ķ�Ӧ����v��A����ʱ��t�Ĺ�ϵ����ͼ��ʾ������Һ�����Ϊ2L������ʼʱֻ����A���ʣ�����˵��������ǣ� ����
2B+C��A�ķ�Ӧ����v��A����ʱ��t�Ĺ�ϵ����ͼ��ʾ������Һ�����Ϊ2L������ʼʱֻ����A���ʣ�����˵��������ǣ� ����
A.ͼ����Ӱ���ֵ������ʾ0��2min��A�����ʵ���Ũ�ȵļ�Сֵ
B.��Ӧ��ʼ��ǰ2min��A��ƽ����Ӧ����С��0.375mol?L-1?min-1
C.��2minʱ��A�����ʵ�����Сֵ����0.5~1mol֮��
D.��2minʱ��B�����ʵ���Ũ��c��B������1~1.5mol?L-1֮��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
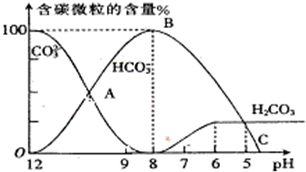 I����������20mL0.1mol?L-1Na2CO3��Һ����μ���0.1mol?L-1 HCl��Һ40mL����Һ��pH���ͣ���ʱ��Һ�к�̼Ԫ�ص������ʵ���Ũ�ȵİٷֺ��������ᣩҲ�����仯��CO2���ݳ�δ����������ͼ��ʾ���ش��������⣺
I����������20mL0.1mol?L-1Na2CO3��Һ����μ���0.1mol?L-1 HCl��Һ40mL����Һ��pH���ͣ���ʱ��Һ�к�̼Ԫ�ص������ʵ���Ũ�ȵİٷֺ��������ᣩҲ�����仯��CO2���ݳ�δ����������ͼ��ʾ���ش��������⣺c(
| ||
c(
|
 H++HA-����HA-
H++HA-����HA- H++A2-
H++A2-�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

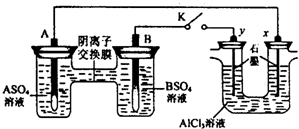
| A����Һ��c��A2+��Ũ�ȼ�С | B��B�ĵ缫��Ӧ��B-2e-?B2+ | C��y�缫����H2������������ԭ��Ӧ | D����Ӧ���ڣ�x�缫��Χ���ְ�ɫ��״���������ó����ܽ� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com