
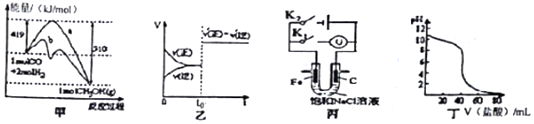
| A. | 图甲表示工业上用CO生成甲醇的反应CO(g)+2H2(g)?CH2OH(g),该反应的△H=-91kJ•mol-1 | |
| B. | 图乙表示已达到平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件可能是加入催化剂 | |
| C. | 图丙中若K1闭合,石墨棒周围溶液pH逐渐升高;若K2闭合,电路中通过0.002NA个电子时,两极理论上共产生0.002mol气体 | |
| D. | 图丁表示盐酸滴加0.1 mol•L-1NaOH溶液的得到的滴定曲线,该实验的指示剂最好选取酚酞 |
分析 A.反应物总能量大于生成物总能量,为放热反应,反应热等于旧键断裂吸收的总能量-新键形成所放出的能量;
B.已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件是加入催化剂或前后气体系数不变的反应增大压强;
C.若闭合K1,该装置没有外接电源,所以构成了原电池;不活泼的石墨棒作正极,正极上氧气得电子生成氢氧根离子;K2闭合,电路中通过0.002 NA个电子时,阴极生成0.001mol氢气,阳极生成0.001mol氯气,共产生0.002mol气体;
D.根据氢氧化钠溶液浓度,求出溶液pH的大小,结合图象分析.
解答 解:A.反应物总能量大于生成物总能量,为放热反应,由图可知CO(g)+2H2(g)?CH3OH(g)△H=419kJ/mol-510kJ/mol=-91kJ•mol-1,故A正确;
B.已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件是加入催化剂或前后气体系数不变的反应增大压强,故B正确;
C.若闭合K1,该装置没有外接电源,所以构成了原电池;不活泼的石墨棒作正极,正极上氧气得电子生成氢氧根离子发生还原反应,电极反应式为2H2O+O2+4e-=4OH-,所以石墨棒周围溶液pH逐渐升高,K2闭合,电路中通过0.002 NA个电子时,阴极生成0.001mol氢气,阳极生成0.001mol氯气,共产生0.002mol气体,故C正确;
D.滴定开始时0.1 mol•L-1NaOH溶液pH=13,与图象不符,故D错误.
故选D.
点评 本题考查较为综合,为高考常见题型,侧重考查学生的分析能力,题目着重于图象的考查,注意把握反应特征的应用、中和滴定的特点,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | -332kJ | B. | -118kJ | C. | +130kJ•mol-1 | D. | +350kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
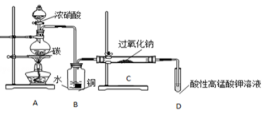 亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量.某兴趣小组进行下面实验探究,查阅资料知道:
亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量.某兴趣小组进行下面实验探究,查阅资料知道:| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1 盐酸测定10mLxmol•L-1氨水.溶液pH随V[(HCl)aq]变化曲线如图所示.下列说法正确的是( )
25℃时,NH3•H2O的电离平衡常数Kb=1.75×10-5,该温度下,用0.01mol•L-1 盐酸测定10mLxmol•L-1氨水.溶液pH随V[(HCl)aq]变化曲线如图所示.下列说法正确的是( )| A. | 原氨水浓度x=0.01mol•L-1 | |
| B. | m、p两点溶液中由水电离出来的c(OH-):m>p | |
| C. | n点溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| D. | 若在m点溶液中加少量水,[c(NH3•H2O)•c(H+)]/c(NH4+)不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al是地壳中含量最多的金属元素,但铝是使用较晚的金属 | |
| B. | Al是比较活泼的金属,在化学反应中容易失去电子,表现还原性 | |
| C. | Al箔在空气中受热可以熔化,且发生剧烈燃烧 | |
| D. | Al箔在空气中受热可以熔化,由于氧化膜的存在,熔化的Al并不滴落 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com