
本题列举的四个选项是4位同学在学习“化学反应的速率和化学平衡”一章后,联系工业生产实际所发表的观点,你认为不正确的是
A.化学反应速率理论是研究怎样在一定时间内快出产品
B.化学平衡理论是研究怎样使用有限原料多出产品
C.化学反应速率理论是研究怎样提高原料转化率
D.化学平衡理论是研究怎样使原料尽可能多地转化为产品
科目:高中化学 来源:2015届吉林省公主岭市高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是( )
A.石灰乳与Na2CO3溶液混合:Ca2++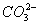
 CaCO3↓
CaCO3↓
B.NH4HSO3溶液与足量NaOH溶液混合加热: +
+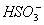 +2OH-
+2OH- NH3↑+
NH3↑+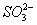 +2H2O
+2H2O
C.酸性条件下KIO3溶液与KI溶液反应生成I2: +5I-+3H2O
+5I-+3H2O 3I2+6OH-
3I2+6OH-
D.AgNO3溶液中加入过量氨水:Ag++NH3?H2O AgOH↓+
AgOH↓+
查看答案和解析>>
科目:高中化学 来源:2015届北京理工附中高三第一次月考化学试卷(解析版) 题型:选择题
现代科学的发展使游离态的氮家庭又添新丁,据报道:意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子。N4分子结构与P4相似,已知断裂1molN-N吸收167kJ热量,生成1molN≡N放出942kJ热量。根据以上信息和数据,下列说法正确的是
A.N4属于一种新型的化合物
B.N4沸点比P4(白磷)高
C.N4与N2互为同素异形体
D.1molN4气体转变为N2将吸收882kJ热量
查看答案和解析>>
科目:高中化学 来源:2015届北京理工附中高三第一次月考化学试卷(解析版) 题型:选择题
下列有关化学反应速率的说法正确的是
A.用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
B.100mL2mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速度不变
C.SO2的催化氧化是一个放热的反应,所以升高温度,反应速率减慢
D.汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率减慢
查看答案和解析>>
科目:高中化学 来源:2015届北京市高三上学期第一次月考化学试卷(解析版) 题型:实验题
甲同学进行Fe2+还原性的实验,针对异常现象进行探究。
步骤一:制取FeCl2溶液。向0.1 mol?L-1 FeCl3溶液中加足量铁粉振荡,静置后取上层清液,测得pH<1。
步骤二:向2 mL FeCl2溶液中滴加2滴0.1 mol?L-1 KSCN溶液,无现象;再滴加5滴5% H2O2溶液(物质的量浓度约为1.5 mol?L-1、pH约为5),观察到溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2)。
(1)用离子方程式表示步骤二中溶液变红的原因: 、 。
(2)甲探究步骤二中溶液褪色的原因:
I.取褪色后溶液两份,一份滴加FeCl3溶液无现象;另一份滴加KSCN溶液出现红色;
II.取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀。
III.向2 mL 0.1 mol?L-1 FeCl3溶液中滴加2滴0.1 mol?L-1 KSCN溶液,变红,通入O2,无明显变化。
实验I的说明 ;
实验III的目的是 。
得出结论:溶液退色的原因是酸性条件下H2O2将SCN-氧化成SO42-。
(3)甲直接用FeCl2·4H2O配制 mol?L-1 的FeCl2溶液,重复步骤二中的操作,发现液体红色并未褪去。进一步探究其原因:
I.用激光笔分别照射红色液体和滴加了KSCN溶液的FeCl3溶液,前者有丁达尔效应,后者无。测所配FeCl2溶液的pH约为3。由此,乙认为红色不褪去的可能原因是 。
II.查阅资料后推测,红色不褪去的原因还可能是pH较大时H2O2不能氧化SCN-。乙利用上述部分试剂,通过实验排除了这一可能。乙的实验操作及现象是:
步骤 | 试剂及操作 | 现 象 |
i |
| 生成白色沉淀 |
ii | 向i所得溶液中滴加0.1 mol?L-1 FeCl3溶液 |
|
查看答案和解析>>
科目:高中化学 来源:2015届北京市高三上学期第一次月考化学试卷(解析版) 题型:选择题
将25%的硫酸溶液和5%的硫酸溶液等体积混合,所得硫酸溶液的质量分数是
A.等于15% B.大于15% C.小于15% D.无法估算
查看答案和解析>>
科目:高中化学 来源:2015届北京市高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列分类依据和结论都正确的是
A.HClO、浓硫酸、HNO3均具有氧化性,都是氧化性酸
B.H2O、HCOOH、Cu2(OH)2CO3均含有氧元素,都是氧化物
C.HF、CH3COOH、CH3CH2OH都易溶于水,都是电解质
D.HCOOH、H2CO3、H2SO4分子中均含有两个氢原子,都是二元酸
查看答案和解析>>
科目:高中化学 来源:2015届北京市朝阳区高三年级第一学期期中统一考试化学试卷(解析版) 题型:选择题
N2O5是一种新型硝化剂,在一定温度下可发生以下反应:
2N2O5(g)  4NO2 (g)+ O2(g) ΔH > 0t℃时,向密闭容器中通入N2O5,部分实验数据见下表:
4NO2 (g)+ O2(g) ΔH > 0t℃时,向密闭容器中通入N2O5,部分实验数据见下表:
时间/s | 0 | 500 | 100 0 | 150 0 |
c(N2O5)/ mol·L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法中不正确的是
A.500 s 内N2O5分解速率为2.96╳10-3mol·L-1·s-1
B.达平衡时,N2O5的转化率为50%
C.达平衡后,升高温度平衡常数减小
D.达平衡后,其他条件不变,将容器的体积压缩到原来的一半,c(N2O5)> 5.00 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com