
| A、氯 | B、溴 | C、钠 | D、镁 |
科目:高中化学 来源: 题型:
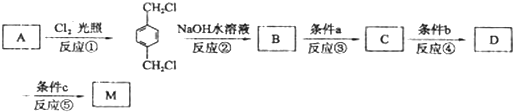
查看答案和解析>>
科目:高中化学 来源: 题型:
 | 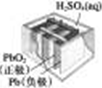 | 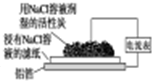 |  |
| 图Ⅰ碱性 锌锰电池 | 图Ⅱ铅硫 酸蓄电池 | 图Ⅲ铝箔的腐蚀 | 图Ⅳ银锌 纽扣电池 |
| A、图Ⅰ所示电池中,MnO2的作用是催化剂,负极反应为:Zn-2e-=Zn2+ |
| B、图Ⅱ所示电池充电过程中,硫酸浓度不断增大,阴极反应为:Pb+SO42-=PbSO4-2e- |
| C、铝制品表面出现白斑可以通过图Ⅲ装置进行探究,Cl-由活性炭区向铝箔表面区迁移,并发生电极反应:2Cl--2e-═Cl2↑ |
| D、图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:
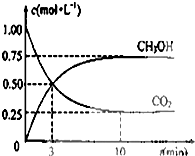 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇,一定条件下发生如下反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇,一定条件下发生如下反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)查看答案和解析>>
科目:高中化学 来源: 题型:
 甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应来制备甲醇.
甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应来制备甲醇.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、60mL | B、40mL |
| C、30mL | D、15mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
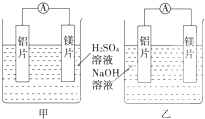 某探究活动小组想利用原电池反应检测金属的活动性顺序,有甲、乙两位同学均使用镁片与铝片作电极,但甲同学将电极放入6mol?L-1稀H2SO4中,乙同学将电极放入6mol?L-1的NaOH溶液中,如图所示.
某探究活动小组想利用原电池反应检测金属的活动性顺序,有甲、乙两位同学均使用镁片与铝片作电极,但甲同学将电极放入6mol?L-1稀H2SO4中,乙同学将电极放入6mol?L-1的NaOH溶液中,如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:

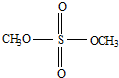 是一种酯类物质,回答下列问题:
是一种酯类物质,回答下列问题: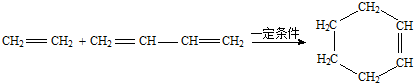 ,Ⅱ有两种同分异构体在一定条件下可相互反应生成
,Ⅱ有两种同分异构体在一定条件下可相互反应生成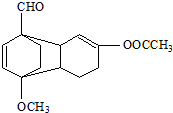 ,这两种同分异构体的结构简式分别为
,这两种同分异构体的结构简式分别为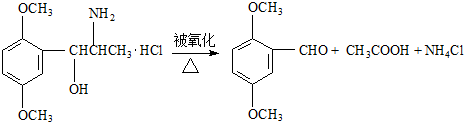
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com