
| A. | 煤的干馏是化学变化 | |
| B. | 煤液化后可以得到甲醇等液体燃料 | |
| C. | 煤中含有苯和甲苯,可以用蒸馏的方法把它们分离出来 | |
| D. | 从萃取分液后溴的四氯化碳溶液中提取溴可以用蒸馏的方法 |
科目:高中化学 来源: 题型:多选题
| A. | ${\;}_{8}^{18}$O,${\;}_{8}^{17}$O | B. | O2,O3 | C. | Fe3+,Fe2+ | D. | ${\;}_{6}^{12}$C,${\;}_{6}^{13}$C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓HNO3的氧化性比稀HNO3,故有时在实验室看到的浓硝酸呈黄色 | |
| B. | Na的金属性比Mg强,故可用Na与MgCl2溶液反应制取Mg | |
| C. | Fe在Cl2中燃烧生成FeCl3,故在与其他非金属反应的产物中Fe也显+3价 | |
| D. | AlCl3易水解,故由AlCl3•6H2O制无水AlCl3应在HCl气流中加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
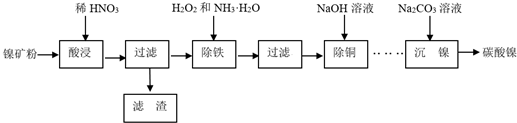
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室制乙烯通常采用95%的乙醇与浓硫酸(体积比为1:3)混合加热到170℃方法制得,其制备原理可表示如下:
实验室制乙烯通常采用95%的乙醇与浓硫酸(体积比为1:3)混合加热到170℃方法制得,其制备原理可表示如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+═Cu2++2Fe2+ | |
| B. | 将Fe3O4固体溶于HI溶液中:Fe3O4+8H+=2Fe3++Fe2++4H2O | |
| C. | 将氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 向FeBr2溶液中通入少量的氯气:2Br-+Cl2=2Cl-+Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
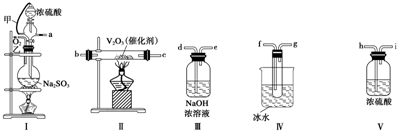
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com