
| A. | SO3和BF3 | B. | SO42-和PO43- | C. | CO2和CNS- | D. | SO32-和CO32- |
分析 根据价层电子对互斥理论确定微粒空间构型,价层电子对个数=σ键+孤电子对个数,孤电子对个数=$\frac{1}{2}$×(a-xb),a为中心原子的价电子数,x为与中心原子结合的原子个数,b为与中心原子结合的原子最多能接受的电子数,据此判断.
解答 解:A.三氧化硫分子中价层电子对个数=σ键个数+孤电子对个数=3+$\frac{1}{2}$(6-3×2)=3,且不含孤电子对,所以为平面三角形结构,BF3中B原子杂化轨道数=δ键数+孤对电子对数=3+0=3,所以分子构型为平面正三角形,故A不选;
B.SO42-中σ键电子对数为4,价层电子对个数是4且不含孤电子对,所以空间构型是正四面体结构,PO43-中心原子为P,其中σ键电子对数为4,中心原子孤电子对数为 $\frac{1}{2}$(5+3-4×2)=0,PO43-价层电子对对数为4+0=4,故立体构型为正四面体,故B不选;
C.CO2分子中碳原子价层电子对=σ 键电子对+中心原子上的孤电子对=2+$\frac{1}{2}$(4-2×2)=2,所以二氧化碳是直线型结构,CNS-中氮原子含有2个σ键和2个π键,不含孤电子对,所以价层电子对数是2,以sp杂化轨道成键,是直线型结构,故C不选;
D.SO32-中心原子S原子孤电子对数=$\frac{6+2-3×2}{2}$=1,所以价层电子对数=3+1=4,S原子采取sp3杂化,含1对孤电子对,立体构型为三角锥形,CO32-的中心原子C原子上含有3个σ 键,中心原子上的孤电子对数=$\frac{1}{2}$(a-xb)=$\frac{1}{2}$(4+2-2×3)=0,所以CO32-的空间构型是平面三角形,故D选;
故选D.
点评 本题考查了微粒空间构型的判断,根据价层电子对理论解答,注意孤电子对个数=$\frac{1}{2}$×(a-xb)中各个字母的含义,气态氯化铝通常以二聚分子形式存在Al采用sp3杂化轨道成键为正四面体结构,为易错点,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 101 | B. | 258 | C. | 157 | D. | 359 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吸收445.2KJ | B. | 吸收480.4KJ | C. | 放出445.2KJ | D. | 放出480.4KJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,W的最高正价为+7.
,W的最高正价为+7.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
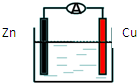
| A. | 锌做负极发生氧化反应 | |
| B. | 供电时的总反应为:Zn+2H+=Zn2++H2↑ | |
| C. | 该装置可实现化学能转化为电能 | |
| D. | 溶液中硫酸根离子向Cu极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nmm | 0.160 | 0.134 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | L2+与R2-的核外电子数相等 | B. | L与T形成的化合物具有两性 | ||
| C. | L和Q金属性:Q<L | D. | 氢化物的稳定性为H2T<H2R |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com