
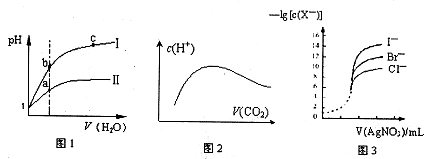
| A��ͼl��ʾͬ�¶��£�pH=1������ʹ�����Һ�ֱ��ˮϡ��ʱpH�ı仯���ߣ��������ߢ�Ϊ���ᣬ��b����Һ�ĵ����Ա�a��ǿ |
| B��������Ϊ1mol��NaOH��Һ��ͨ��CO2������CO2�����ͨ�룬��Һ��ˮ�������c(H+)������ͼ2�仯��ϵ |
| C������ͼ2��ʾ��ˮ�����c(H+)�ﵽ���ֵʱ����Һ�и�����Ũ�ȴ�С�ֱ�Ϊ c(Na+)��c(OH��)��c(CO32-)��c(HCO3-)��c(H+) |
| D����0��0l00mol/L����������Һ���ζ�Ũ�Ⱦ�Ϊ0��1000mol/LCl����Br����I���Ļ����Һ����ͼ3���ߣ���ȷ�����ȳ�������Cl�� |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���

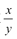 ��ֵ___���ƫ����ƫС�����䡱
��ֵ___���ƫ����ƫС�����䡱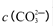
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| ʵ�� ��� | HA�����ʵ���Ũ��(mol��L��1) | NaOH�����ʵ���Ũ��(mol��L��1) | ��Ϻ���Һ��pH |
| �� | 0.1 | 0.1 | pH��a |
| �� | 0.12 | 0.1 | pH��7 |
| �� | 0.2 | 0.1 | pH��7 |
| �� | 0.1 | 0.1 | pH��10 |
 H����B2��
H����B2���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| ʵ����� | 1 | 2 | 3 | 4 |
| ����NaOH��Һ�����(mL) | 20.05 | 20.00 | 18.50 | 19.95 |
| ����Ũ��(mol/L) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 H����A2��
H����A2���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| ���� | NaHCO3 | Na2CO3 | NaCN |
| pH | 9.7 | 11.6 | 11.1 |
 ��С
��С�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| ���ữѧʽ | CH3COOH | HCN | H2CO3 |
| ����ƽ�ⳣ�� (25 ��) | 1.8��10��5 | 4.9��10��10 | K1��4.3��10��7 K2��5.6��10��11 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 ��H+��Fe2+��Al3+��Cu2+�����Ʊ������ܴ��Բ���̼���̣�MnCO3��������һ�ֹ�ҵ�������£�
��H+��Fe2+��Al3+��Cu2+�����Ʊ������ܴ��Բ���̼���̣�MnCO3��������һ�ֹ�ҵ�������£�


�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com