
| A、AlCl3溶液中加入过量氨水 |
| B、Al2(SO4)3溶液中加入过量KOH溶液 |
| C、MgCl2溶液中加入过量氨水 |
| D、澄清石灰水中通入过量CO2 |


科目:高中化学 来源: 题型:
| A、全部都是 | B、①②③⑤⑥ |
| C、①②③④⑤ | D、③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ①5种阳离子为:Mg2+、Ba2+、Fe3+、X、Y |
| ②5种阴离子为:OH-、Cl-、CO32-、NO3-、Z |
| ③X是短周期主族元素中金属性最强的元素形成的简单阳离子;Y是简单的阳离子,具有10个电子,且离子半径是10个电子离子中最小的. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、③⑤⑥ | B、③⑦ |
| C、⑤⑥⑦ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
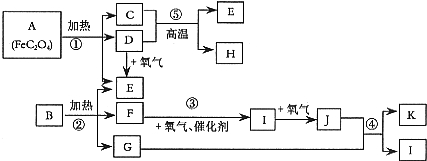
查看答案和解析>>
科目:高中化学 来源: 题型:
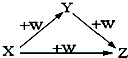 X、Y、Z、W有如图所示的转化关系,则X、Y可能是( )
X、Y、Z、W有如图所示的转化关系,则X、Y可能是( )| A、①②③ | B、①② |
| C、③④ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
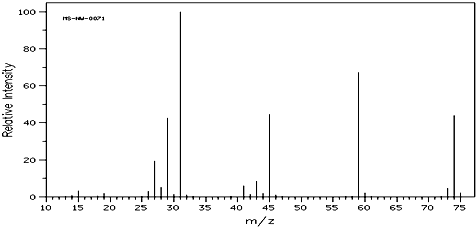
查看答案和解析>>
科目:高中化学 来源: 题型:
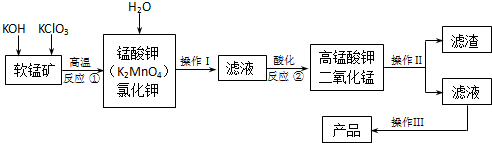
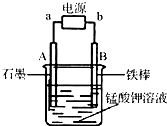
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2F2+2H2O═4HF+O2 |
| B、Na2O+H2O═2NaOH |
| C、2Na+2H2O═2NaOH+H2↑ |
| D、Cl2+H2O═HCl+HClO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com