
 向1000mL3mol•L-1NaOH中通入适量CO2气体,溶液中有关阴离子的物质的量变化曲线如图所示:下列说法正确的是( )
向1000mL3mol•L-1NaOH中通入适量CO2气体,溶液中有关阴离子的物质的量变化曲线如图所示:下列说法正确的是( )| A. | 水的电离程度一直增大 | |
| B. | 溶液的pH逐渐下降 | |
| C. | M、N两点对应的溶液中离子种类不同 | |
| D. | CD段反应的离子方程式为OH-+CO2=HCO3- |
分析 NaOH溶液中通入二氧化碳气体,先发生反应:2OH-+CO2=CO32-+H2O(OB段),氢氧根离子完全转化成碳酸根离子后,发生反应:H2O+CO32-+CO2=2HCO3-,(CD或BE段),所以曲线ACE表示氢氧根离子的物质的量变化,MBE为碳酸根离子的变化,CD表示碳酸氢根离子的变化,据此对各选项进行判断.
解答 解:NaOH溶液中通入二氧化碳气体,先发生反应:2OH-+CO2=CO32-+H2O(OB段),氢氧根离子完全转化成碳酸根离子后,发生反应:H2O+CO32-+CO2=2HCO3-,(CD或BE段),所以曲线ACE表示OH-的物质的量变化,MBE为CO32-离子的变化,CD表示HCO3-的变化,
A.氢氧化钠与二氧化碳反应生成碳酸钠的过程中,水的电离程度逐渐增大,当碳酸根离子与二氧化碳反应生成碳酸氢根离子的过程中,水的电离程度逐渐减小,故A错误;
B.反应过程中,溶液中氢氧根离子浓度逐渐减小,则溶液的pH逐渐减小,故B正确;
C.M、N的溶液中都含有:OH-、CO32-、HCO3-、H+和Na+离子,含有的离子种类相同,故C错误;
D.CD段碳酸根离子浓度逐渐减小、碳酸氢根离子浓度逐渐增大,反应反应为:H2O+CO32-+CO2=2HCO3-,故D错误;
故选B.
点评 本题考查了酸碱混合的定性判断、水的电离的影响因素及其应用,题目难度中等,明确曲线中对应反应为解答关键,注意掌握水的电离及其影响因素,试题培养了学生灵活应用基础知识的能力.


科目:高中化学 来源: 题型:解答题
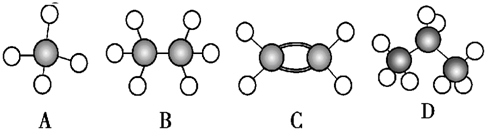
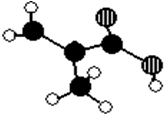 某化工厂生产的某产品A只含C、H、O三种元素,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等).
某化工厂生产的某产品A只含C、H、O三种元素,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等).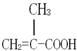 ,含有的官能团名称碳碳双键,羧基.
,含有的官能团名称碳碳双键,羧基. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
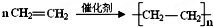 .
.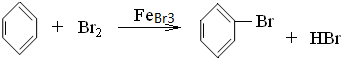 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体扩散速率与扩散面积成正比 | |
| B. | 气体扩散速率与气体溶解度和分子量成正比 | |
| C. | 气体扩散速率与分压差成正比 | |
| D. | 气体扩散速率与温度成正比 | |
| E. | 气体扩散速率与扩散距离成反比 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 已知阴离子交换膜只允许阴离子通过.某化学课外活动小组采用如下方案对印刷电路废液(溶质主要是FeCl2、CuCl2和 FeCl3)进行再生:先向废液中加入过量铁粉,充分反应后过滤,再将滤液转入图所示的装置中进行电解.下列说法中不正确的是( )
已知阴离子交换膜只允许阴离子通过.某化学课外活动小组采用如下方案对印刷电路废液(溶质主要是FeCl2、CuCl2和 FeCl3)进行再生:先向废液中加入过量铁粉,充分反应后过滤,再将滤液转入图所示的装置中进行电解.下列说法中不正确的是( )| A. | 电解时,电极a应与外电源的正极相连 | |
| B. | 电解时,电极b周围产生无色无味的气体 | |
| C. | 电解时,电极a发生的反应是:2Cl--2e-=Cl2↑ | |
| D. | 电解时,可以用氯化钠溶液替代稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
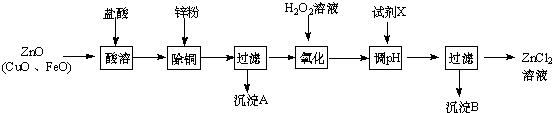
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Zn2+ | 5.2 | 6.4 |
| Fe2+ | 5.8 | 8.8 |
 ,聚乳酸的结构简式为
,聚乳酸的结构简式为 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com