
| A. | Ca2+、K+、Cl-、NO3- | B. | Ag+、Na+、NO3-、Cl- | ||
| C. | Cu2+、K+、SO42-、Cl- | D. | Ba2+、NH4+、SO42-、Cl- |
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠能与碱反应,可用作食品的膨松剂 | |
| B. | 钠具有很强的还原性,可用钠与TiCl4反应制取钛 | |
| C. | Al2O3具有很高的熔点,可用于制造熔融烧碱的坩埚 | |
| D. | 铜的金属活泼性比铁强,可用于保护石油管道(碳素钢管)以减缓其腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
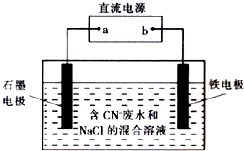 工业上,在强碱性条件下用电解法除去废水中的CN-,装置如右图所示,依次发生的反应有:
工业上,在强碱性条件下用电解法除去废水中的CN-,装置如右图所示,依次发生的反应有:| A. | 除去1 mol CN-,外电路至少需转移5 mol电子 | |
| B. | 通电过程中溶液的pH不断增大 | |
| C. | 为了使电解池连续工作,需要不断补充NaCl | |
| D. | 铁电极上发生的反应为Fe一2e一═Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2(SO4)3=2Al+3+3SO4-2 | B. | K2SO4=2K++S6++4O2- | ||
| C. | CuCl2=Cu2++2Cl- | D. | Na2CO3=Na++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | XO${\;}_{3}^{2-}$ | B. | ZO${\;}_{4}^{2-}$ | C. | YO${\;}_{2}^{-}$ | D. | WO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com