
已知:SO2(g)+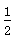 O2(g)
O2(g) 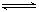 SO3(g) ΔH=-98 kJ/mol。某温度下,向一体积为2 L的密闭容器中充入0.2 mol SO2和0.1 mol O2,5 min后达到平衡,共放出热量11.76 kJ,下列说法正确的是
SO3(g) ΔH=-98 kJ/mol。某温度下,向一体积为2 L的密闭容器中充入0.2 mol SO2和0.1 mol O2,5 min后达到平衡,共放出热量11.76 kJ,下列说法正确的是
A.5 min内用O2表示的反应速率为0.12 mol/(L·min)
B.该反应的平衡常数数值为7.5
C.SO2的平衡转化率为60%
D.加入催化剂,可使ΔH变小
科目:高中化学 来源:2014-2015学年浙江省杭州市高一10月月考化学试卷(解析版) 题型:填空题
(1)100mL0.25 mol·L—1 CaCl2溶液中,Ca2+ 的物质的量为 ;含CaCl2质量为 ;若溶液密度为1.04g/mL,则溶液的质量分数为 。
(2)标准状态下448升氯化氢气体,所含氯化氢的物质的量为 ,将其全部溶解成1升溶液,所得盐酸密度为1.095 g/mL,则盐酸的质量分数为 。盐酸的物质的量浓度为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高二上学期期中考试化学试卷(解析版) 题型:选择题
一定条件下,在密闭容器内,SO2氧化成SO3的热化学方程式为:2SO2(g)+O2(g)  2SO3(g);△H=-akJ·mo1-1 在相同条件下要想得到2akJ热量,加入各物质的物质的量可能是
2SO3(g);△H=-akJ·mo1-1 在相同条件下要想得到2akJ热量,加入各物质的物质的量可能是
A.4 mo1SO2和2mol O2
B.4mol SO2、2mo1 O2和2mol SO3
C.4mol SO2.和4 mo1 O2
D.6mo1 SO2和4 mo1 O2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省东阳外国语学校高二上学期期中化学试卷(解析版) 题型:实验题
(12分)影响化学反应速率的因素很多,某课外兴趣小组用实验的方法通过图1所示装置研究反应速率的有关问题。
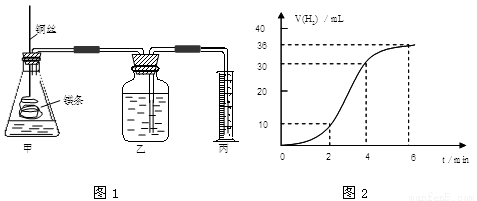
(1)取一段镁条,用砂纸擦去表面的氧化膜,使镁条浸入锥形瓶内足量的稀盐酸中。足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图2所示。
①请在图3的方框中画出上述反应的速率与时间的关系曲线。
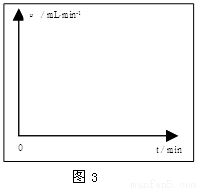
②在前4min内,镁条与盐酸的反应速率逐渐加快,在4min之后,反应速率逐渐减慢,请简述其原因: 。
(2)某同学发现,纯度、质量、表面积都相同的两铝片与H+浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝和盐酸反应速率更快。他决定对其原因进行探究。填写下列空白:
①该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因Ⅰ:Cl-对反应具有促进作用,而SO2- 4对反应没有影响;
原因Ⅱ:Cl-对反应没有影响,而SO2- 4对反应具有阻碍作用;
原因Ⅲ: ;
原因Ⅳ:Cl-、SO2- 4均对反应具有促进作用,但Cl-影响更大;
原因Ⅴ: 。
②该同学设计并进行了两组实验,即得出了正确结论。他取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和盐酸的试管(两试管的规格相同)中:
a.在盛有硫酸的试管中加入少量 固体 ,观察反应速率是否变化;
b.在盛有盐酸的试管中加入少量 固体,观察反应速率是否变化。
通过观察到实验a和实验b现象,从而得出结论。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省东阳外国语学校高二上学期期中化学试卷(解析版) 题型:选择题
体积相同,浓度均为0.1mol/L的NaOH溶液、氨水,分别加水稀释m倍、n倍,溶液的pH都变成9,则m与n的关系为
A.4m=n B.m=n C.m<n D.m>n
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省东阳外国语学校高二上学期期中化学试卷(解析版) 题型:选择题
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的①NaOH固体 ②H2O ③NH4Cl固体 ④CH3COONa固体 ⑤NaNO3溶液 ⑥KCl溶液
A.②④⑥ B.①② C.②③⑤ D.②④⑤⑥
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省东阳外国语学校高二上学期期中化学试卷(解析版) 题型:选择题
在一定条件下,对于A2(g)+3B2(g) 2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
2AB3(g)反应来说,以下化学反应速率的表示中,化学反应速率最快的是
A.v(A2)=0.8 mol·L-1·s-1
B.v(A2)=30 mol·L-1·h-1
C.v(AB3)=1.0 mol·L-1·s-1
D.v(B2)=1.2 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江台州中学高二上学期第一次统练化学试卷(解析版) 题型:选择题
电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:
Pb+PbO2+4H++2SO42- 2PbSO4+2H2O,
2PbSO4+2H2O,
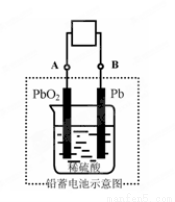
则下列说法正确的是:
A.放电时:电子流动方向由A经导线流向B
B.放电时:正极反应是Pb-2e-+SO42- PbSO4
PbSO4
C.充电时:铅蓄电池的负极应与充电器电源的正极相连
D.充电时:阳极反应是PbSO4-2e-+2H2O PbO2+SO42-+4H+
PbO2+SO42-+4H+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南鄢陵县第一高中高二上第一次考试化学(A)试卷(解析版) 题型:选择题
对于可逆反应:2M(g)+N(g) 2P(g) ΔH<0,下列各图中正确的是( )
2P(g) ΔH<0,下列各图中正确的是( )
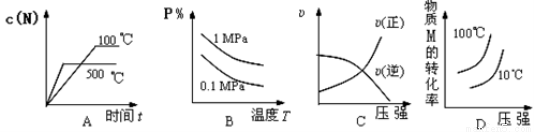
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com