
| 编号 | 反应条件 | 反应速率 |
| (1) | 升高温度 | |
| (2) | 加入催化剂 | |
| (3) | 再充入a mol H2 | |
| (4) | 将容器容积扩大为原来2倍 | |
| (5) | 通入b mol Ne(g) |


科目:高中化学 来源: 题型:
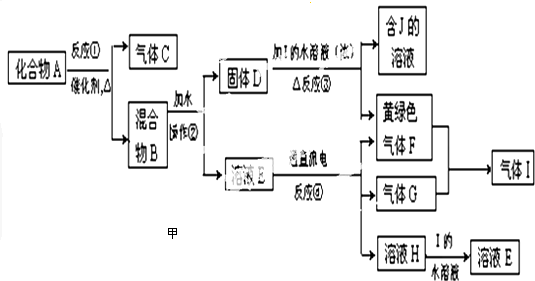
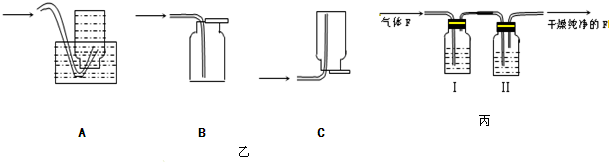
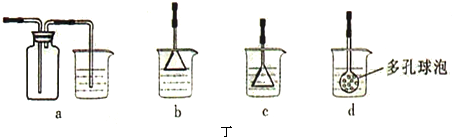
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、上述反应中,N2是还原剂,Al2O3是氧化剂 |
| B、上述反应中,CO为还原产物,具有还原性 |
| C、上述反应中,每生成1 mol AlN需转移3 mol电子 |
| D、AlN的摩尔质量为41 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CuSO4+H2S=CuS↓+H2SO4 | ||||
| B、2FeCl3+Cu=2FeCl2+CuCl2 | ||||
C、Cu2(OH)2CO3
| ||||
| D、FeCl3+3NaOH=Fe(OH)3↓+3NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O2既是氧化剂,又是还原剂 |
| B、反应的氧化产物只有O2 |
| C、当反应产生标准状况下2.24LO2时,转移的电子为0.1mol |
| D、向高锰酸钾溶液中滴加浓盐酸可以得到酸性高锰酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制480mL 1mol/L的稀硫酸.可供选用的仪器有:
如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制480mL 1mol/L的稀硫酸.可供选用的仪器有:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②④⑤ | B、②③⑤ |
| C、②⑤ | D、①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com