
【题目】以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeC13·6H2O)的工艺流程如下,下列说法错误的是
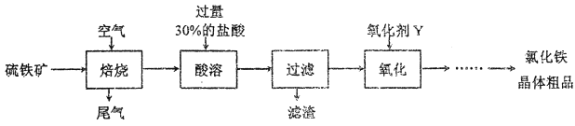
A. 将硫铁矿粉碎再焙烧的目的是加快反应速率
B. 酸溶时需保持盐酸过量的目的是提高铁元素的浸出率
C. 氧化剂Y可以是Cl2不能是H2O2
D. 上述流程中的FeS2可用FeS来代替
科目:高中化学 来源: 题型:
【题目】已知某酸性溶液中含有Ba2+、Fe3+,则下述离子组中能与上述离子共存的是( )
A.CO32-、Cl-B.NO3-、Cl-C.NO3-、SO42-D.OH-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素。碘元素以碘离子的形式存在。实验室从海藻中提取碘的流程如下:

(1)指出从海藻中提取I2的实验操作名称:
①____________,③__________②的离子方程式__________,。
(2)提取碘的过程中,可供选择的有机溶剂是(____)。
A 甲苯、酒精 B 四氯化碳、苯
C 汽油、乙酸 D 汽油、甘油
(3)为使海藻中I-转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器。还缺少的仪器是________。
(4)从含碘的有机溶剂中提取碘,还要经过蒸馏,指出下列蒸馏装置中的错误之处__________。
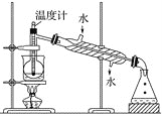
(5)进行蒸馏操作时,使用水浴加热的原因是_________________,最后晶态碘在________中。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子。回答下列问题:
(1)b、c、d第一电离能大小关系为___________________,e的外围电子排布图为_____________________。
(2)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为_________;分子中既含有极性共价键,又含有非极性共价键的化合物是_____________(填化学式,写两种)。
(3)这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构;阳离子呈轴向狭长的八面体结构(如下图所示)。该化合物中阴离子为__________,阳离子中存在的化学键类型有________________;
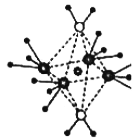
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中可以获得淡水、食盐,并可提取镁和溴等物质.
(1)从海水中提取镁的流程如下图所示:

反应①的离子方程式为_______________________________________________
反应②的化学方程式为_______________________________________________
(2)海水提取溴流程:

该流程中涉及发生反应的离子方程式:①_______________________②________________________
该流程中溴元素被氧化又被还原又被氧化的目的是:_______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸的电离方程式为CH3COOH(aq)![]() H+(aq)+CH3COO-(aq) ΔH>0。25℃时,0.1mol/L醋酸溶液中存在下述关系:Ka=c(H+).c(CH3COO-)/c(CH3COOH)=1.75×10-5,其中的数值是该温度下醋酸的电离平衡常数(Ka)。下列说法正确的是
H+(aq)+CH3COO-(aq) ΔH>0。25℃时,0.1mol/L醋酸溶液中存在下述关系:Ka=c(H+).c(CH3COO-)/c(CH3COOH)=1.75×10-5,其中的数值是该温度下醋酸的电离平衡常数(Ka)。下列说法正确的是
A. 向该溶液中滴加几滴浓盐酸,平衡逆向移动,c(H+)减小
B. 向该溶液中加少量CH3COONa固体,平衡正向移动
C. 该温度下0.01mol/L醋酸溶液Ka<1.75×10-5
D. 升高温度,c(H+)增大,Ka变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的排列顺序是
①20 mL 0.01 mol/L KCl溶液 ②30 mL 0.02 mol/L CaCl2溶液
③40 mL 0.03 mol/L HCl溶液 ④10 mL 蒸馏水⑤50 mL 0.05 mol/L AgNO3溶液
A. ①>②>③>④>⑤ B. ④>①>③>②>⑤
C. ⑤>④>②>①>③ D. ④>③>⑤>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关电化学知识的描述正确的是
A. 由于CaO+H2O![]() Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池
Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池
B. 当马口铁(镀锡铁)的镀层破损后,马口铁腐蚀会加快
C. 原电池的电极附近溶液pH的变化可以用电池总反应式来判断
D. 铅蓄电池放电时的正极反应式为PbO2 +4H+ +2e-![]() Pb2+ +2H2O
Pb2+ +2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com