
某同学组装了如图所示的电化学装置,电极Ⅰ为Al,其他电极均为Cu,则 ( )
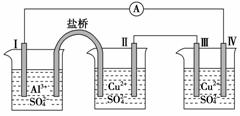
A. 电流方向:电极Ⅳ→Ⓐ→电极Ⅰ
B. 电极Ⅰ发生还原反应
C. 电极Ⅱ逐渐溶解
D. 电极Ⅲ的电极反应:Cu2++2e-===Cu
 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
下列有关有机物性质的说法正确的是( )。
A.蛋白质可以与酸、碱或重金属盐反应
B.芳香烃都不能使酸性KMnO4溶液褪色
C.CH3CH2OH与氢溴酸不能反应
D.石油的分馏可获得乙烯、丙烯等不饱和烃
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,可逆反应N2(g)+3H2(g)
 2NH3(g) ΔH<0,达到平衡,当单独改变下列条件后,有关叙述错误的是( )
2NH3(g) ΔH<0,达到平衡,当单独改变下列条件后,有关叙述错误的是( )
A.加催化剂,v正、v逆都发生变化且变化的倍数相等
B.加压,v正、v逆都增大,且v正增大倍数大于v逆增大倍数
C.降温,v正、v逆都减小,且v正减小倍数小于v逆减小倍数
D.加入氩气,v正、v逆都增大,且v正增大倍数大于v逆增大倍数
查看答案和解析>>
科目:高中化学 来源: 题型:
有甲、乙两容器,甲容器容积固定,乙容器容积可变。一定温度下,在甲中加入2 mol N2、3 mol H2,反应N2(g)+3H2(g)
 2NH3(g)达到平衡时生成NH3的物质的量为m mol。
2NH3(g)达到平衡时生成NH3的物质的量为m mol。
(1)相同温度下,在乙中加入4 mol N2、6 mol H2,若乙的压强始终与甲的压强相等,乙中反应达到平衡时,生成NH3的物质的量为________mol(从下列各项中选择,只填序号,下同);若乙的容积与甲的容积始终相等,乙中反应达到平衡时,生成NH3的物质的量为________mol。
A.小于m B.等于m C.在m~2m之间 D.等于2m E.大于2m
(2)相同温度下,保持乙的容积为甲的一半,并加入1 mol NH3,要使乙中反应达到平衡时各物质的体积分数与上述甲容器中达到平衡时相同,则起始应加入______mol N2和________mol H2。
查看答案和解析>>
科目:高中化学 来源: 题型:
在硫酸工业中,通过下列反应使SO2氧化成SO3:
2SO2(g)+O2(g)
 2SO3(g) ΔH=-198 kJ·mol-1。(已知制SO3过程中催化剂是V2O5,它在400℃~500℃时催化效果最好)
2SO3(g) ΔH=-198 kJ·mol-1。(已知制SO3过程中催化剂是V2O5,它在400℃~500℃时催化效果最好)
下表为不同温度和压强下SO2的转化率(%):
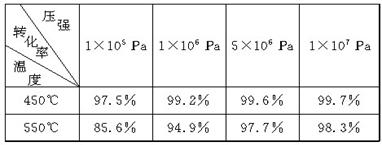
(1)根据化学理论综合分析,为了使二氧化硫尽可能转化为三氧化硫,可控制的条件是________________________________________________________________________。
(2)实际生产中,选定400℃~500℃作为操作温度,其原因是
________________________________________________________________________。
(3) 实际生产中,采用的压强为常压,其原因是
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(4) 在生产中,通入过量空气的目的是
________________________________________________________________________
________________________________________________________________________。
(5)尾气中有SO2,必须回收是为了
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列装置中,MSO4和NSO4是两种常见金属的易溶盐。当K闭合时,SO 从右到左通过交换膜移向M极,下列分析正确的是(双选)( )
从右到左通过交换膜移向M极,下列分析正确的是(双选)( )
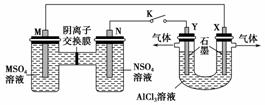
A.溶液中c(M2+)减小
B.N的电极反应式:N-2e-===N2+
C.X电极上有H2产生,发生还原反应
D.反应过程中X电极周围生成白色胶状沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质能使品红溶液褪色,且褪色原理基本相同的组合是( )
①活性炭 ②氯水 ③二氧化硫 ④臭氧 ⑤过氧化钠 ⑥双氧水
A.①②④ B.②③⑤
C.②④⑤⑥ D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
溶液的酸碱性和pH:
(1)25 ℃,0.01 mol·L-1的盐酸中,c(OH-)=________ mol·L-1,pH=____________,由水电离出的c(H+)=________。
(2)100 ℃时,pH=6的水中c(H+)=________ mol·L-1,该水显________性。
(3)100 ℃时(Kw=10-12),0.01 mol·L-1的NaOH溶液的pH为________________,由水电离出的c(OH-)=________。
(4)25 ℃时,pH=8的CH3COONa溶液中c(OH-)=__________________,由水电离的c(OH-)=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:

某活动小组测定制取的Na2S2O3·5H2O的纯度的方法如下:准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。反应原理为2S2O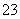 +I2===S4O
+I2===S4O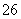 +2I-
+2I-
(5)滴定至终点时,溶液颜色的变化:____________________________________________。
(6)测定起始和终点的液面位置如图,则消耗碘的标准溶液体积为________mL。产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com