
【题目】下图表示在没有通风橱时制取纯净的氯气时设计的装置图,图中A、B是可控制的弹簧铁夹。
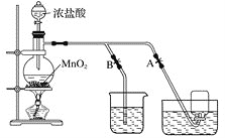
(1)烧杯中盛放的液体是__________,其作用是_________,水槽中盛放的液体是_________。
(2)简述操作过程:(从氯气已经产生开始)在收集氯气之前,应__________________________;当氯气纯度合乎要求时,应__________________________________,当氯气收集完毕时,应______。
(3)将8.7 g二氧化锰与含氯化氢14.6 g的浓盐酸共热制氯气,甲同学认为可制得氯气 7.1 g,乙同学认为制得氯气的质量小于7.1 g,你认为________(填“甲”或“乙”)同学正确,原因是_________。
【答案】氢氧化钠溶液 吸收多余的氯气 饱和食盐水 打开B夹,关闭A夹 打开A夹,关闭B夹 关闭A夹,打开B夹 乙 ①浓盐酸易挥发;②随着反应进行,浓盐酸浓度会降低,稀盐酸将不再反应
【解析】
(1)实验室常用二氧化锰和浓盐酸在加热条件下生成氯气,根据氯气的性质分析解答;
(2)根据氯气的性质判断其收集方法以及尾气处理的方法;
(3)根据反应特点以及稀盐酸和二氧化锰不反应分析解答。
(1)因为氯气有毒,可污染空气,要进行尾气吸收,并且氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,所以常用氢氧化钠溶液吸收尾气,烧杯中盛放氢氧化钠溶液收;氯气在饱和氯化钠溶液中的溶解度较小,实验室常用排饱和食盐水法收集氯气,即水槽中盛放的液体是饱和食盐水;
(2)氯气在饱和氯化钠溶液中的溶解度很小,实验室常用排饱和食盐水法收集氯气,收集时,为得到较为纯净的氯气,应先排除装置内的空气,则应打开B夹,关闭A夹;收集时,应打开A夹,关闭B夹,收集完毕,关闭A夹,打开B夹,多余的气体通入氢氧化钠溶液进行吸收,防止污染空气;
(3)由于浓盐酸易挥发,随着反应进行,浓盐酸浓度会降低,稀盐酸将不再反应,所以制得氯气的质量小于7.1 g。


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
【题目】钒是一种熔点很高的金属,具有良好的可塑性和低温抗腐蚀性,有延展性、硬度大,无磁性。广泛应用于钢铁、航空航天、能源、化工等领域。中铝集团 (平果铝业公司)目前使用一种新型工艺,以便从铝业生成的固体废料——赤泥中提取金属钒,具体工艺流程图如下:
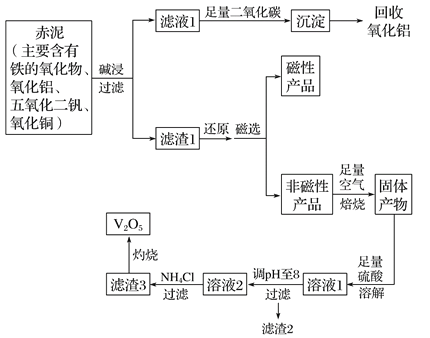
已知:
I.钒有多种价态,其中+5价最稳定。钒在溶液中主要以VO2+和VO3-的形式存在,存在平衡
VO2++H2O![]() VO3-+2H+。
VO3-+2H+。
Ⅱ.部分含钒物质在水中的溶解性如下表所示:
物质 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 难溶 | 难溶 | 易溶 |
Ⅲ.部分离子的沉淀pH值:
Cu2+ | Fe2+ | Fe3+ | |
开始沉淀pH值 | 5.2 | 7.6 | 2.7 |
完全沉淀pH值 | 6.4 | 9.6 | 3.7 |
请回答下列问题:
(1)碱浸步骤中最好选用 。
A.NaOH溶液 B.氨水 C.纯碱溶液
(2)写出滤液1与足量二氧化碳反应的离子方程式 。
(3)磁选步骤得到的磁性产品为 。
(4)溶液1到溶液2的过程中,调节pH值至8有两个目的,一是除去铜离子,二是使 。
(5)滤渣3的主要成分为 ,工业上常用铝热反应法由V2O5冶炼金属钒,请写出反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,将2 mol CO与5 mol H2的混合气体充入容积为2 L的密闭容器中,在催化剂的作用下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。经过5 min后,反应达到平衡,此时H2的转化率为60%。
CH3OH(g)。经过5 min后,反应达到平衡,此时H2的转化率为60%。
(1)该反应的平衡常数为________,v(CH3OH)=________mol·L-1·min-1。若保持体积不变,再充入2 mol CO和1.5 mol CH3OH,此时v(正)________v(逆)(填“>”“<”或“=”)。
(2)在一定压强下,容积为VL的容器充入amol CO与2amol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。则ΔH___0,p1____p2(填“大于”“小于”或“等于”)。
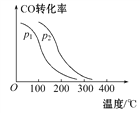
(3)能使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a.及时分离出CH3OH气体 b.适当升高温度 c.增大H2的浓度 d.选择高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电化学装置的说法正确的是

A. 利用图a装置处理银器表面的黑斑Ag2S,银器表面的反应为Ag2S+2e-=2Ag+S2-
B. 图b电解一段时间,铜电极溶解,石墨电极上有亮红色物质析出
C. 图c中的X极若为负极,则该装置可实现粗铜的精炼
D. 图d中若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化铟和砷化铟纳米晶具备独特的光学和电学特性,广泛应用于生物医学、通信、太阳能电池等领域。回答下列问题:
(1)基态磷原子电子排布式为____________;基态As原子中未成对电子数为__________。
(2)PH3分子空间构型为_______;AsO33-中As原子的杂化方式为____________。
(3)AsH3与NH3在水中溶解度较大的是________,其原因是_________________。
(4)酞菁铟是有机分子酞菁与金属铟形成的复杂分子,结构简式如下图I所示,该分子中存在的化学键为___(填选项字母)。

(5)砷化铟的晶胞绐构如上图II所示,砷化铟晶体的化学式为_______________;该晶胞的棱长为acm,则砷化铟晶体的密度为__________(用含a、NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应N2+3H2![]() 2NH3是工业上合成氨的重要反应。
2NH3是工业上合成氨的重要反应。
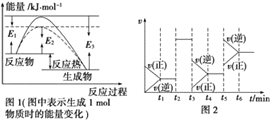
(1)根据图1请写出合成氨的热化学方程式__________________(热量用El、E2或E3表示)。
(2)图1中虚线部分是通过改变化学反应中的_________条件,该条件的改变与图2中哪一时刻条件的改变相同_________(用“t1……t6”表示)。
(3)图2中t3时刻改变的条件是_________,t5与时刻改变的条件是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可充电电池的原理如图所示,已知a、b为惰性电极,溶液呈酸性。充电时右槽溶液颜色由绿色变为紫色。下列叙述正确的是

A. 放电时,H+从左槽迁移进右槽
B. 放电过程中,左槽溶液颜色由黄色变为蓝色
C. 充电时,b极接直流电源正极,a极接直流电源负极
D. 充电过程中,a极的电极反应式为:VO2++2H++e- = VO2++H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】事物是相互影响、相互制约的。在有机化合物分子中,这种相互影响、相互制约同样存在。例如:
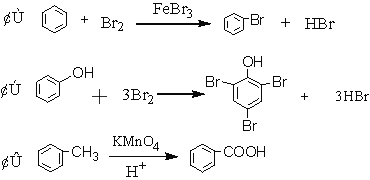
下列性质不能说明基团之间相互影响的是( )
A. ②用浓溴水而①用液溴;①需用催化剂而②不需用。
B. ②生成三溴取代产物而①只生成一溴取代产物。
C. CH3CH2OH无明显酸性,而![]() 显弱酸性。
显弱酸性。
D. 乙醇能使酸性高锰酸钾溶液褪色,而苯酚不能。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作、现象与结论均正确的是( )
选项 | 操作 | 现象 | 结论 |
A | 向FeCl3和KSCN混合溶液中,加入少量KCl的固体 | 溶液颜色变浅 | FeCl3+3KSCN |
B | 向待测液中依次滴入氯水和KSCN溶液 | 溶液变为红色 | 待测液中含有Fe2+ |
C | 向装有X溶液的试管中滴入浓NaOH溶液,将干燥红色石蕊试纸置于试管口 | 无明显现象 | X溶液中无NH4+ |
D | 乙醇和重铬酸钾溶液混合 | 橙色溶液变为绿色 | 乙醇具有还原性 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com