

分析 X能与盐酸、氢氧化钠反应都生成气体,应为弱酸铵盐,与盐酸反应得到气体A,A能与过氧化钠反应生成气体D,则A为CO2、D为O2,X与氢氧化钠反应得到气体C为NH3,A与C物质的量之比为1:1,且B为常见液体,可以推知X为NH4HCO3、B为H2O,C(氨气)与D(氧气)反应生成E为NO,E与氧气反应生成F为NO2,F与水反应得到G能与Cu反应生成NO、NO2,则G为HNO3,据此解答.
解答 解:X能与盐酸、氢氧化钠反应都生成气体,应为弱酸铵盐,与盐酸反应得到气体A,A能与过氧化钠反应生成气体D,则A为CO2、D为O2,X与氢氧化钠反应得到气体C为NH3,A与C物质的量之比为1:1,且B为常见液体,可以推知X为NH4HCO3、B为H2O,C(氨气)与D(氧气)反应生成E为NO,E与氧气反应生成F为NO2,F与水反应得到G能与Cu反应生成NO、NO2,则G为HNO3,
(1)由上述分析可知,F是NO2,X是NH4HCO3,
故答案为:NO2;NH4HCO3;
(2)Cu与硝酸反应生成硝酸铜与氮的氧化物,反应中N元素的化合价部分为不变化,部分降低,故硝酸表现酸性、氧化性,
故答案为:酸性和氧化性;
(3)NH4HCO3与过量NaOH溶液反应的离子方程式为:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+CO+NH3↑,
故答案为:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+CO+NH3↑;
(4)C→E反应的化学方程式:4 NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4 NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(5)以NH3、H2O、O2为原料可生产HNO3,使a mol NH3完全转化为HNO3,根据电子转移守恒,理论上至少需要氧气的物质的量=$\frac{amol×[5-(-3)]}{4}$=2a mol,
故答案为:2a;
(6)C与G的反应产物为硝酸铵,含有的阳离子为NH4+,检验NH4+的方法:取少量样品于试管中,加入氢氧化钠并加热,把湿润的红色石蕊试纸放在试管口,试纸变蓝,说明含有NH4+,
故答案为:取少量样品于试管中,加入氢氧化钠并加热,把湿润的红色石蕊试纸放在试管口,试纸变蓝,说明含有NH4+.
点评 本题考查无机物推断,难度中等,注意根据X既能与盐酸又能与氢氧化钠反应生成气体及A能与过氧化钠反应生成气体进行推断,(5)中注意利用电子转移守恒解答.


科目:高中化学 来源: 题型:选择题
 最近,科学家从石墨中分离出来的石墨烯是已知最薄、最坚硬的物质.可以制成纳米材料.其结构如图所示:下列关于石墨烯的说法正确的是( )
最近,科学家从石墨中分离出来的石墨烯是已知最薄、最坚硬的物质.可以制成纳米材料.其结构如图所示:下列关于石墨烯的说法正确的是( )| A. | 属于高分子化合物 | B. | 与金刚石互为同分异构体 | ||
| C. | 性质稳定不能与氧气等物质反应 | D. | 能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用10mL量筒量取8.10mL稀盐酸 | |
| B. | 用pH计测得某溶液的pH为2.3 | |
| C. | 用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸 | |
| D. | 可用50.00mL碱式滴定管量取20.00mL KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往某溶液中滴加BaCl2溶液,产生白色沉淀,则原溶液中一定含SO42- | |
| B. | 往某溶液中滴加稀硝酸酸化的硝酸银溶液,产生白色沉淀,则原溶液中一定含Cl- | |
| C. | 取某溶液进行焰色反应,透过蓝色钴玻璃焰色为紫色,则原溶液的溶质一定是钾盐 | |
| D. | 往某溶液中通入CO2,产生白色沉淀,则原溶液中一定含SiO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水玻璃可用于生产黏合剂和防火剂 | |
| B. | 误服重金属盐,立即服用牛奶或豆浆可解毒 | |
| C. | 油脂、乙酸乙酯都属于酯类,但不是同系物 | |
| D. | 蔗糖、淀粉、纤维素水解的最终产物都只是葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
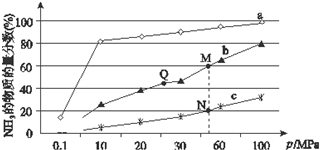 合成氨反应是化学上最重要的反应之一:
合成氨反应是化学上最重要的反应之一:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com