
【题目】张亭栋研究小组受民间中医启发,发现As2O3(俗称砒霜)对白血病有明显的治疗作用。氮(N)、磷(P)、砷(As)等都是VA族的元素,该族元素的化合物在研究和生产中有许多重要用途。回答下列问题:
(1)NH3的沸点比PH3_____(填“高"或“低”),原因是_____________。
(2)Na3AsO4 中含有的化学键类型包括_______;AsO43-的空间构型为_______,As4O6的分子结构如图所示,则在该化合物中As的杂化方式是_________。
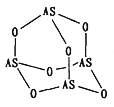
(3)自然固氮现象发生的一系列化学变化:N2→NO→NO2→HNO3→NO3-解释了民谚“雷雨发庄稼”的原理。
①NO3-中N原子采取_____杂化方式,其空间构型为________,写出它的一种等电子体的化学式________.
②已知酸性: HNO3>HNO2,下列相关见解合理的是_________.
A.含氧酸中氧原子总数越多,酸性越强
B.同种元素化合价越高,对应含氧酸的酸性越强
C.HNO3中氮元素的正电性更高,在水溶液中更易电离出H+,酸性强于HNO2
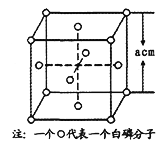
(4)白磷(P4)的晶体属于分子晶体,其晶胞结构如图(小圆圈表示白磷分子)。己知晶胞的边长为acm,阿伏加德罗常数为NA mol-1,则该晶胞中含有的P原子的个数为______,该晶体的密度为______g·cm-3(用含NA、a的式子表示)。
【答案】 高 NH3分子间存在较强的氢键,而PH3分子间仅有范德华力 离子键、共价键 正四面体 sp3 sp2 平面三角形 SO3、CO32- BC 16 ![]()
【解析】(1)NH3和PH3都属于分子晶体,都存在范德华力,但由于NH3分子间存在氢键,导致NH3的沸点比PH3高。答案为:高、NH3分子间存在较强的氢键,而PH3分子间仅有范德华力
(2)Na3AsO4属于离子化合物,含有离子键,酸根离子中含有共价键;AsO43-中As原子孤电子对数=![]() ,价层电子对数为4+0=4,据此判断空间构型为正四面体;As4O6的分子中As原子形成3个AsO键,含有1对孤对电子,杂化轨道数目为4,所以杂化类型为sp3杂化;答案为:离子键、共价键,正四面体 ,sp3
,价层电子对数为4+0=4,据此判断空间构型为正四面体;As4O6的分子中As原子形成3个AsO键,含有1对孤对电子,杂化轨道数目为4,所以杂化类型为sp3杂化;答案为:离子键、共价键,正四面体 ,sp3
(3)①硝酸根中N原子价电子层电子为3对,理想模型为平面三角形,没有孤电子对,其杂化方式为sp2杂化;与硝酸根为等电子体的物质为:SO3、CO32-等
②A. 判断含氧酸(含有氧元素的酸)酸性强弱的一条经验规律是:同种元素化合价越高,含氧酸中氧原子总数越多酸性越强,A中没有指明同一种元素,所以A错误;B. 同种元素化合价越高,含氧酸中氧原子总数越多酸性越强,B正确;C.HNO3中氮元素化合价更高,得到电子能力强,所以相较HNO2酸性更强,C正确。所以选择BC。答案为:①sp2 、平面三角形、 SO3或CO32- ②BC
(4)根据均摊法可知,晶胞中P4分子数目为8×![]() +6×
+6× ![]() = 4,则晶胞中P原子数目为4×4=16,晶胞质量为16×
= 4,则晶胞中P原子数目为4×4=16,晶胞质量为16×![]() g,晶胞体积为(acm)3,则晶胞密度为:
g,晶胞体积为(acm)3,则晶胞密度为:![]() =
=![]() =
=![]() =
=![]() g·cm-3
g·cm-3
故答案为:16 、 ![]()


科目:高中化学 来源: 题型:
【题目】元素周期表是学习化学的重要工具,下图所示为元素周期表中的一部分。表中所列的字母分别代表对应的化学元素。
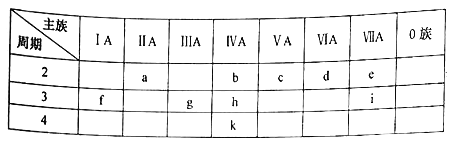
(1)上述元素中,金属性最强的元素在周期表中的位置是______;最高价氧化物对应水化物中酸性最强的元素是___________(填元素符号)。常温下,其单质在浓硝酸中会发生钝化的元素是_______(填元素符号)。
(2)元素g的简单离子结构示意图为______,元素d的一种氢化物中两种原子的个数比为1: 1,则该物质的电子式为___________
(3)k元素可能的性质或应用有________。
A.是一种活泼的金属元素 B.其简单氢化物的热稳定性比h强
C.其单质可作为半导体材料 D.最高正化合价为+4
(4)下列说法正确的是________
A.简单离子半径的大小顺序: r(d>r(e>r(g)>r(f)
B.元素非金属性由强到弱的顺序:e>d>c
C.f、g、i最高价氧化物对应的水化物两两之间能发生反应
D.化合物f2d2中,阴、阳离子个数之比为1:1
(5)元素a与元素g有相似的化学性质。请写出元素a的氢氧化物与NaOH溶液反应的化学方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能说明元素的金属性或非金属性相对强弱的是( )
序号 | 事实 | 推论 |
A | S(s)+H2(g)=H2S(g) ΔH <0 Se(s)+H2(g)=H2Se(g) ΔH >0 | 非金属性:S >Se |
B | Li在O2中点燃生成Li2O 而Na在O2中点燃生成Na2O2 | 金属性:Na >Li |
C | SO2与NaHCO3溶液反应生成CO2 | 非金属性:S > C |
D | t℃时,Br2 + H2 I2 + H2 | 非金属性:Br > I |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确是( )
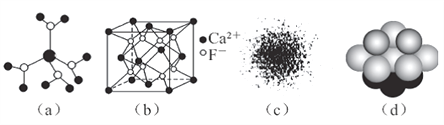
A. 水合铜离子的模型如图(a)所示,1个水合铜离子中有4个配位体
B. CaF2晶体的晶胞如图(b)所示,每个CaF2晶胞平均占有4个Ca2+
C. H原子的电子云图如图(c)所示,H原子核外大多数电子在原子核附近运动
D. 金属Cu中Cu原子堆积模型如图(d),为最密堆积,每个Cu原子的配位数均为12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,加入2molA和1molB发生如下反应:2A(g)+B(?)![]() 2C(g)+D(g),C的体积分数(C%) 随时间的变化趋势符合右下图关系:下列说法正确的是( )
2C(g)+D(g),C的体积分数(C%) 随时间的变化趋势符合右下图关系:下列说法正确的是( )
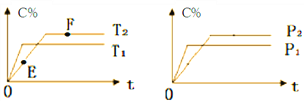
A. E点的v(逆)大于F点的v(正)
B. 若在F点时给容器加压,达新平衡时C的浓度将增大
C. 若给容器加热,该反应的平衡常数K将增大
D. 恒温恒容下达平衡后,向容器中再加入2molA和1molB,A的转化率不发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以证明可逆反应N2+3H2![]() 2NH3已达到平衡状态的是
2NH3已达到平衡状态的是
①一个N≡N键断裂的同时,有3个H﹣H键断裂
②一个N≡N键断裂的同时,有6个N﹣H键断裂
③其他条件不变时,混合气体平均相对分子质量不再改变
④恒温恒容时,体系压强不再改变
⑤NH3、N2、H2的体积分数都不再改变
⑥恒温恒容时,混合气体密度保持不变
⑦正反应速率v(H2)=0.6molL﹣1min﹣1,逆反应速率v(NH3)=0.4molL﹣1min﹣1
A. 全部 B. ②③④⑤ C. ②③④⑤⑦ D. ③⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如何防止铁的锈蚀是工业上研究的重点内容。为研究铁的锈蚀,某同学做了探究实验,如下图所示,铁处于①②③三种不同的环境中

请回答:
(1)金属腐蚀主要分为__________腐蚀和_____________腐蚀两种。
(2)铁被腐蚀的速率由快到慢的顺序是_________________(填序号)。
(3)①中正极的电极反应式为_________________________________________________,②中负极的电极反应式为_________________________________________。
(4)据资料显示,全世界每年因腐蚀而报废的金属材料相当于其年产量的20%以上。为防护金属被腐蚀可采取的措施有__________(填序号)。
①健身器材刷油漆 ②自行车钢圈镀铬
③将钢管用导线与铜条连接 ④将钢管用导线与碳棒连接
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com