
硅及其化合物是重要的非金属材料。由石英砂制取高纯硅的主要化学反应有:
①粗硅的制取:SiO2+2C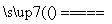 Si(粗)+2CO
Si(粗)+2CO
②粗硅中Si与Cl2反应:Si(s)+2Cl2(g)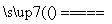 SiCl4(g) ΔH=-akJ/mol
SiCl4(g) ΔH=-akJ/mol
③粗硅的提纯反应:SiCl4(g)+2H2(g)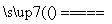 Si(s)+4HCl(g)'ΔH
Si(s)+4HCl(g)'ΔH
请回答下列问题:
(1)上述三个反应都属于________(填反应类型)。
(2)已知1mol Si固体中有2mol Si-Si键,1mol O2中有1mol O=O键,1mol SiO2固体中有4mol Si-O键。某些化学键数据如下:
| 化学键 | Si-O | Cl-Cl | H-H | H-Cl | Si-Si | O=O |
| 断键所需能量/(kJ·mol-1) | 460 | 243 | 436 | 431 | 176 | 498 |
根 据化学键数
据化学键数 据写出Si(s)在O2中完全燃烧生成SiO2的热化学方程式:_____________________________________________________ _________________________________________________________。
据写出Si(s)在O2中完全燃烧生成SiO2的热化学方程式:_____________________________________________________ _________________________________________________________。
(3)可由反应②和另一个反应______________________________ (填化学方程式)通过盖斯定律计算获得反应③的反应热,若该反应每生成1mol化合物的反应热ΔH=-bkJ/mol,则反应③的反应热ΔH=________kJ/mol(用含a、b的代数式表示)。
科目:高中化学 来源: 题型:
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是( )

A.最简单气态氢化物的热稳定性:R>Q
B.最高价氧化物对应水化物的酸性:Q<W
C.原子半径:T>Q>R
D.含T的盐溶液一定显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃、101 kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5 518 kJ/mol。下列热化方程式书写正确的是( )
A.2H+(aq)+SO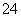 (aq)+Ba2+(aq)+2OH-(aq)===BaSO4(s)+2H2O(l) ΔH=-57.3 kJ/mol
(aq)+Ba2+(aq)+2OH-(aq)===BaSO4(s)+2H2O(l) ΔH=-57.3 kJ/mol
B.KOH(aq)+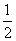 H2SO4(aq)===
H2SO4(aq)===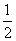 K2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol
K2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol
C.C8H18(l)+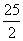 O2(g)===8CO2(g)+9H2O(g) ΔH=-5 518 kJ/mol
O2(g)===8CO2(g)+9H2O(g) ΔH=-5 518 kJ/mol
D.2C8H18(g)+25O2(g)===16CO2(g)+18H2O(l) ΔH=-5 518 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
有关热化学方程式书写与对应表述均正确的是 ( )
A.稀醋酸与0.1 mol·L-1 NaOH溶液反应:H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1
B.密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量,则Fe(s)+S(s)===FeS(s) ΔH=-95.6 kJ·mol-1
C.氢气的燃烧热为285.5 kJ·mol-1,则水电解的热化学方程式为2H2O(l)===2H2(g)+O2(g) ΔH=+28 5.5 kJ·mol-1
5.5 kJ·mol-1
D.已知2C(s)+O2(g)===2CO(g ) ΔH=-221 kJ·mol-1,则可知C的燃烧热为110.5 kJ·mol
) ΔH=-221 kJ·mol-1,则可知C的燃烧热为110.5 kJ·mol -1
-1
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
|
| A. | 1.0mol•L﹣1的KNO3溶液:H+、Fe2+、Cl﹣、SO42﹣ |
|
| B. | 含有大量Fe2+的溶液中:H+、Mg2+、ClO﹣、NO3﹣ |
|
| C. | c(H+)=10﹣12mol•L﹣1的溶液:K+、Ba2+、Cl﹣、Br﹣ |
|
| D. | 能使Al溶解产生H2的溶液中:NH4+、Na+、SiO32﹣、HCO3﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数,下列叙述正确的是( )
|
| A. | 0.1mol•L﹣1的Na2CO3溶液中含CO32﹣为0.1NA |
|
| B. | 3.2 g O2和O3的混合气中氧原子数为0.2NA |
|
| C. | 1mol H3O+含质子数为10 NA |
|
| D. | 标准状况下,22.4 L乙醇的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
ClO2是饮用水消毒剂.用ClO2处理过的饮用水(pH为5.5~6.5)除含有ClO2外,常含有一定量对人体不利的ClO2﹣.为测定此饮用水中两者成分,进行如下实验:准确量取v mL水样加入到锥形瓶中,调节水样pH=8,加人足量KI晶体,发生如下反应:2ClO2+2I﹣=I2+2ClO2﹣,反应结束后产生amol I2;继续调节溶液pH=1,又发生如下反应:ClO2﹣+4H+=2I2+Cl﹣+2H2O,反应结束后叉产生b mol I2.饮用水中c(ClO2﹣)= 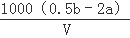 mol•L﹣ 1(用含字母的代数式表示).
mol•L﹣ 1(用含字母的代数式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
硫—碘循环分解水制氢主要涉及下列反应 :
:
Ⅰ SO2+2H2O+I2===H2SO4+2HI
Ⅱ 2HI H2+I2
Ⅲ 2H2SO4===2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是________。
a.反应Ⅲ易在常温下进行
b.反应Ⅰ中SO2氧化性比HI强
c.循环过程中需补充H2O
d.循环过程产生1 mol O2的同时产生1 mol H2
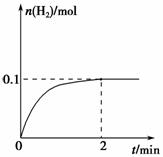 (2)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。
(2)一定温度下,向1 L密闭容器中加入1 mol HI(g),发生反应Ⅱ,H2物质的量随时间的变化如图所示。
0~2 min内的平均反应速率
v(HI)=________。该温度下,
H2(g)+I2(g)  2HI(g)的平衡常数K=________。
2HI(g)的平衡常数K=________。
相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则________是原来的2倍。
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3)实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡________移动(填“向左”、“向右”或“不”);若加入少量下列试剂中的________,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以H2为燃料可制作氢氧燃料电池。
已知2H2(g)+O2(g)===2H2O(l) ΔH=-572 kJ·mol-1某氢氧燃料电池释放228.8 kJ电能时,生成1 mol液态水,该电池的能量转化率为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com