
 水解反应(取代反应)A、B、C、D均为含苯环的有机物,且相对分子质量B>A>C.已知有机物A的结构简式为
水解反应(取代反应)A、B、C、D均为含苯环的有机物,且相对分子质量B>A>C.已知有机物A的结构简式为
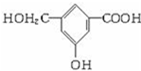 ;1 mol A、C完全燃烧消耗O2的量相等,则C与A的分子组成相差一个或若干个H2O或CO2,又1 mol C能与1 mol NaOH反应,则C为
;1 mol A、C完全燃烧消耗O2的量相等,则C与A的分子组成相差一个或若干个H2O或CO2,又1 mol C能与1 mol NaOH反应,则C为 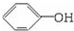 ;D不与NaHCO3反应无-COOH,但应有
;D不与NaHCO3反应无-COOH,但应有 (因B、D为同分异构体),又等质量的D消耗Na和NaOH的物质的量之比为2:3,则D中含有酚羟基,可能含有醇羟基.若含酯基、酚羟基时D为
(因B、D为同分异构体),又等质量的D消耗Na和NaOH的物质的量之比为2:3,则D中含有酚羟基,可能含有醇羟基.若含酯基、酚羟基时D为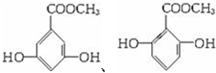 ,若含酯基、酚羟基、醇羟基,则D为
,若含酯基、酚羟基、醇羟基,则D为 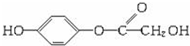 ,然后结合有机物的结构与性质来解答.
,然后结合有机物的结构与性质来解答. ;1 mol A、C完全燃烧消耗O2的量相等,则C与A的分子组成相差一个或若干个H2O或CO2,又1 mol C能与1 mol NaOH反应,则C为
;1 mol A、C完全燃烧消耗O2的量相等,则C与A的分子组成相差一个或若干个H2O或CO2,又1 mol C能与1 mol NaOH反应,则C为  ;D不与NaHCO3反应无-COOH,但应有
;D不与NaHCO3反应无-COOH,但应有 (因B、D为同分异构体),又等质量的D消耗Na和NaOH的物质的量之比为2:3,则D中含有酚羟基,可能含有醇羟基.若含酯基、酚羟基时D为
(因B、D为同分异构体),又等质量的D消耗Na和NaOH的物质的量之比为2:3,则D中含有酚羟基,可能含有醇羟基.若含酯基、酚羟基时D为 ,若含酯基、酚羟基、醇羟基,则D为
,若含酯基、酚羟基、醇羟基,则D为  ,
,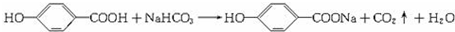 ,
,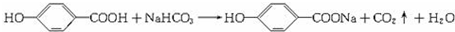 ;
;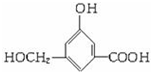 ,-OH、-COOH均与Na反应,酚-OH、-COOH与NaOH反应,只有-COOH与NaHCO3反应,则等物质的量的B消耗Na、NaOH、NaHCO3的物质的量之比为3:2:1,故答案为:
,-OH、-COOH均与Na反应,酚-OH、-COOH与NaOH反应,只有-COOH与NaHCO3反应,则等物质的量的B消耗Na、NaOH、NaHCO3的物质的量之比为3:2:1,故答案为: ;3:2:1;
;3:2:1;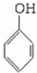 ,故答案为:
,故答案为: ;
;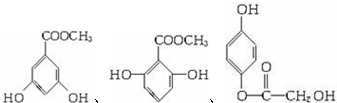 ,
, 中的任意2种.
中的任意2种.


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
| 实验 编号 |
HA物质的量 | NaOH物质的量 | 混合溶液 |
| 浓度(mol?L-1) | 浓度(mol?L-1) | 的pH | |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
| c(H3O+)c(OH-) |
| c(H2O) |
| c(H3O+)c(O2-) |
| c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| CuO | CO | Cu | CO2 |
| 0.8mol | 0.4mol | 0.6mol | 0.6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、燃烧时有浓厚的黑烟 |
| B、实验室制乙炔时可用CuSO4除杂质气体 |
| C、为了减缓电石和水的反应速率,可用饱和食盐水来代替 |
| D、乙炔的收集方法可用排空气法收集 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该NaCl溶液显酸性 |
| B、该NaCl溶液显中性 |
| C、该NaCl溶液中Kw=c(H+)?c(OH-)=1×10-14 |
| D、该NaCl溶液中Kw=c(H+)?c(OH-)=1×10-12 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com