
【题目】A、B、C、D、E代表前四周期原子序数依次增大的五种元素。A、D同主族且有两种常见化合物DA2和DA3;工业上电解熔融C2A3制取单质C;B、E除最外层均只有2个电子外,其余各层全充满,E位于元素周期表的ds区。回答下列问题:
(1)B、C中第一电离能较大的是 ______,基态D原子价电子的轨道表达式为______。
(2)DA2分子的VSEPR模型是 ______。H2A比H2D熔、沸点高得多的原因是 ______。
(3)实验测得C与氯元素形成化合物的实际组成为C2Cl6,其球棍模型如图所示。已知C2Cl6 在加热时易升华,与过量的NaOH溶液反应可生成Na[C(OH)4]。
![]()
① C2Cl6属于_____晶体(填晶体类型),其中C原子的杂化轨道类型为_____杂化。
② [C(OH)4]-中存在的化学键有___________。
(4)工业上制备B的单质是电解熔融B的氯化物,而不是电解BA,原因是________。
(5)B、C的氟化物晶格能分别是2957 kJ·molˉ1、5492 kJ·molˉ1,二者相差很大的原因是_______
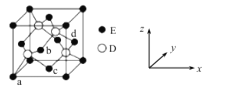
(6)D与E所形成化合物晶体的晶胞如图所示。在该晶胞中,E的配位数为___________。
【答案】镁(或Mg) ![]() 平面三角形 H2O分子间存在氢键 分子 sp3 极性共价键、配位键(或共价键、配位键) 熔融MgCl2能导电,可电解,MgO熔沸点高,电解熔融MgO能耗大 Al3+比Mg2+电荷高、半径小,AlF3的晶格能比MgCl2大得多 4
平面三角形 H2O分子间存在氢键 分子 sp3 极性共价键、配位键(或共价键、配位键) 熔融MgCl2能导电,可电解,MgO熔沸点高,电解熔融MgO能耗大 Al3+比Mg2+电荷高、半径小,AlF3的晶格能比MgCl2大得多 4
【解析】
A、B、C、D、E是前四周期原子序数依次增大的五种元素。A、D同主族且能形成两种常见化合物DA2和DA3,可知A为O,D为S,工业上电解熔融C2A3制取单质C,则C为Al,基态B、E原子的最外层均只有2个电子,其余各电子层均全充满,E位于元素周期表的ds区,结合原子序数可知,B的电子排布为1s22s22p63s2、E的电子排布为1s22s22p63s23p63d104s2,B为Mg,E为Zn,据此分析解答。
由上述分析可知,A为O元素,B为Mg元素,C为Al元素,D为S元素,E为Zn元素。
(1)Mg的3s电子全满为稳定结构,难失去电子,则元素Mg与Al第一电离能较大的是Mg;基态S原子的价电子的轨道表达式为![]() ,故答案为:Mg;
,故答案为:Mg;![]() ;
;
(2)DA2为SO2,根据VSEPR理论,价电子对数为=2+![]() =3,VSEPR模型为平面三角形;H2O分子间存在氢键,导致H2O比H2S熔沸点高,故答案为:平面三角形;H2O分子间存在氢键;
=3,VSEPR模型为平面三角形;H2O分子间存在氢键,导致H2O比H2S熔沸点高,故答案为:平面三角形;H2O分子间存在氢键;
(3)①Al2Cl6在加热时易升华,可知其熔沸点较低,可判断为分子晶体,根据图示,Al形成4根共价键,3根为σ键,1根为配位键,其杂化方式为sp3,故答案为:分子;sp3;
②[Al(OH)4]-中,含有H-O极性共价键,氢氧根与铝离子间还形成了配位键,故答案为:极性共价键、配位键;
(4)MgCl2和MgO都是离子晶体,熔融状态都能电离、导电,但MgO的离子键强,晶格能大,熔融时能耗大,所以工业上电解熔融MgCl2制备Mg,故答案为:熔融MgCl2能导电,可电解,MgO熔点高,电解熔融MgO能耗大;
(5)B、C的氟化物分别为MgF2和AlF3,晶格能分别是2957kJ/mol、5492kJ/mol,二者相差很大,二者均为离子晶体,但Al3+比Mg2+电荷高、半径小,AlF3的晶格能比MgCl2大,故答案为:Al3+比Mg2+电荷高、半径小,AlF3的晶格能比MgCl2大得多;
(6)根据晶胞结构,Zn为面心立方最密堆积,S为四面体填隙,ZnS晶胞中S的配位数为4,而ZnS中Zn、S的原子个数比是1∶1,所以Zn的配位数也是4,故答案为:4。


科目:高中化学 来源: 题型:
【题目】现有可逆反应.2NO2(g)![]() N2O4(g),△H<0,试根据下列图象,判断t2、t3、t4时刻采取的措施。
N2O4(g),△H<0,试根据下列图象,判断t2、t3、t4时刻采取的措施。
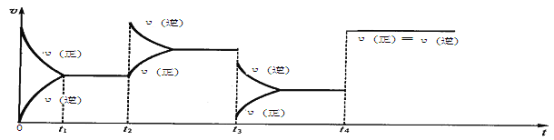
t2:_______________________________________________;
t3:_______________________________________________;
t4:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸镍是一种重要的化工中间体,是镍行业研究的热点。一种以石油化工中的废镍催化剂(主要成分为NiCO3和SiO2,还含有少量Fe2O3、Cr2O3)为原料制备硫酸镍的工业流程如图:

已知:Ⅰ.NiS、Ni(OH)2、Cr(OH)3均难溶于水,Cr(OH)3是两性氢氧化物;
Ⅱ.Fe(OH)3不溶于NH4Cl-氨水的混合液,Ni(OH)2溶于NH4Cl氨水的混合液生成[Ni(NH3)6]2+。
请回答下列问题:
(1)“酸溶”时为加快反应速率,提高镍元素的浸出率,可以采取的措施有:________。
(2)“滤渣Ⅰ”的主要成分为__(填化学式),该物质在工业上的用途为_________(任写一种)。
(3)“一次碱析”时,加入的NaOH溶液需过量,其目的是_________。
(4)“氨解”发生反应的离子方程式为________。“净化”时通入H2S的目的是_______。
(5)“氧化”时发生反应的化学方程式为_________。
(6)“系列操作”具体是指_________、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析正确的是

A.b→d反应的离子方程式为:H++OH-=H2O
B.o→a反应的离子方程式为:Ba2++OH-+H++SO42-=BaSO4↓+H2O
C.c点导电能力相同,所以两溶液中含有相同量的OH–
D.a、b两点Ba2+均沉淀完全,所以对应的溶液均显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中,A为一种中学化学中常见的单质,B、C、D、E是含有A元素的常见化合物。它们的焰色实验均为黄色。
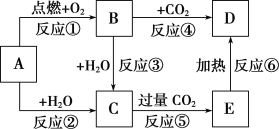
(1)写出下列物质的化学式:B___。
(2)以上6个反应中属于氧化还原反应的有___(填写编号)。
(3)写出A →C反应的离子方程式___。
(4)写出B→C反应的离子方程式:___;E→D的化学方程式:___。
(5)加热5.00gD和E的固体混合物,使E完全分解,固体混合物的质量减少了0.31g,则原混合物中D的质量分数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述与图象相对应的是
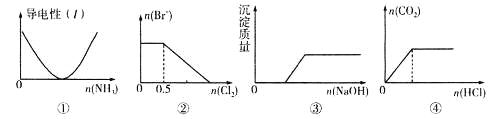
A.图①表示向乙酸溶液中通入氨气至过量的过程中溶液导电性的变化
B.图②表示向1 L l mol·L-1FeBr2溶液中通入Cl2时Br-物质的量的变化
C.图③表示向Ca(HCO3)2溶液中滴加NaOH溶液时沉淀质量的变化
D.图④表示向一定浓度的Na2CO3溶液中滴加盐酸,生成CO2的物质的量与滴加盐酸物质的量的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列几种类推结论符合事实的是
A.氯水可以将 Fe2+氧化至 Fe3+,则碘水也可以将 Fe2+氧化至 Fe3+
B.Fe3O4 可改写为 FeO·Fe2O3,则 Fe3Cl8 也可改写为 FeCl2·2FeCl3
C.Cl2+H2OHCl+HClO 是氧化还原反应,则 ICl+H2OHCl+HIO 也是氧化还原反应
D.CO2 溶于 H2O 生成 H2CO3,则 SiO2 也能溶于 H2O 生成 H2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学---选修5有机化学基础)2005年诺贝尔化学奖授予了研究烯烃复分解反应的科学家,以表彰他们作出的卓越贡献。烯烃复分解反应原理如下:现以烯烃C5H10为原料,合成有机物M和N,合成路线如下:
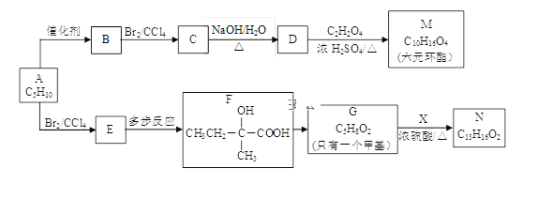
(1)按系统命名法,有机物A的名称是___________。
(2)B的结构简式是___________。
(3)写出D![]() M的化学方程式___________。
M的化学方程式___________。
(4)写出E![]() F合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)___________。
F合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)___________。
(5)已知X的苯环上只有一个取代基,且取代基无甲基,则N的结构简式为_________。
(6)满足下列条件的X的同分异构体共有_____种,写出任意一种的结构简式_____。
①遇FeCl3溶液显紫色 ②苯环上的一氯取代物只有两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.二溴乙烷和水、溴苯和水、硝基苯和水三对物质都能用分液漏斗进行分离
B.苯与甲烷都不能使酸性高锰酸钾褪色,而甲苯能使酸性高锰酸钾褪色,则苯环使得甲基活化
C.甲苯与足量![]() 加成的产物的一氯代物有5种同分异构体
加成的产物的一氯代物有5种同分异构体
D.在溴乙烷中加入适量的氢氧化钠溶液,加热一段时间,再滴入几滴硝酸银溶液,会有沉淀析出,则溴乙烷在碱性条件下能水解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com