
| 消耗量 |
| 起始量 |
| 消耗量 |
| 起始量 |
| 0.48mol/L |
| 0.5mol/L |
| 12g |
| 120g/mol |


科目:高中化学 来源: 题型:
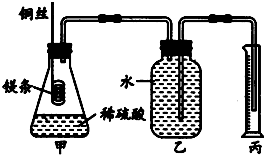 化学兴趣小组设计测定镁原子的摩尔质量的实验,简易装置如图,除去表面氧化膜的镁条质量为0.24g,镁条完全反应后,用量筒收集水,体积为0.224L(设已折换成标准状况下的对应的气体体积).
化学兴趣小组设计测定镁原子的摩尔质量的实验,简易装置如图,除去表面氧化膜的镁条质量为0.24g,镁条完全反应后,用量筒收集水,体积为0.224L(设已折换成标准状况下的对应的气体体积).查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
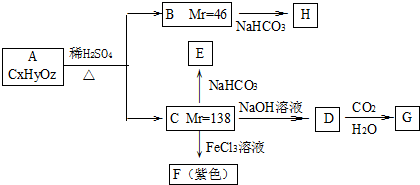
| NaHCO3 |
| CO2+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 浓硫酸 |
| △ |
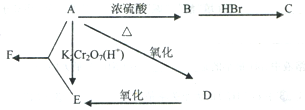
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | A | B | C | D |
| 实验目的 | NaOH溶液与泥沙分离 | 从浓食盐水中得到氯化钠晶体 | 提纯碘水中的I2 | 分离乙醇与水 |
| 分离方法 | 过滤 | 蒸馏 | 萃取、分液 | 蒸馏 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com