
【题目】铅的单质、氧化物、盐在现代T业中有着重要用途。
I.(1)铅能形成多种氧化物,如碱性氧化物PbO、酸性氧化物PbO2、还有组成类似Fe3O4的PbO2。请将Pb3O4改写成简单氧化物的形式: ___。
Ⅱ.以废旧铅酸电池中的含铅废料铅膏(Pb、PbO、PbO2、PbSO4等)为原料,制备超细PbO,实现铅的再生利用。其工作流程如下:
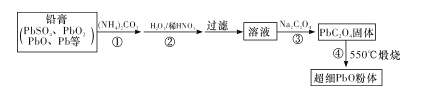
(2)步骤①的目的是“脱硫”,即将PbSO4转化为PbCO3,反应的离子方程式为____。 “脱硫过程”可在如图所示的装置中进行。实验条件为:转化温度为35℃,液固比为5:1,转化时间为2h。
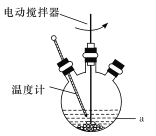
①仪器a的名称是____;转化温度为35℃,采用的合适加热方式是____。
②步骤②中H2O2的作用是____(用化学方程式表示)。
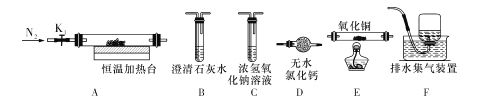
(3)草酸铅受热分解生成PbO时,还有CO和CO2生成,为检验这两种气体,用下图所示的装置(可重复选用)进行实验。实验装置中,依次连接的合理顺序为A ___(填装置字母代号),证明产物中有CO气体的实验现象是____。
(4)测定草酸铅样品纯度:称取2.5 g样品,酸溶后配制成250 mL溶液,然后量取25. 00 mL该溶液,用0. 050 00 mol/L的EDTA( Na2H2Y)标准溶液滴定其中的Pb2+(反应方程式为____,杂质不反应),平行滴定三次,平均消耗EDTA标准溶液14. 52 mL。
①若滴定管未用EDTA标准液润洗,测定结果将 ___(填“偏高”“偏低”或“不变”)。
②草酸铅的纯度为 ___(保留四位有效数字)。
【答案】2PbO·PbO2 CO32-+ PbSO4= SO42-+ PbCO3 三颈烧瓶 热水浴 PbO2+ H2O2+2HNO3=Pb(NO3)2+2H2O+O2↑ BCBDEBF E中黑色固体粉末变为红色,其后的B装置中澄清石灰水变浑浊 Pb2++ H2Y 2-=PbY2-+2H+ 偏高 85.67%
【解析】
I.(1)根据碱性氧化物PbO、酸性氧化物PbO2,表明Pb元素常见的化合价为+2价和+4价,据此分析判断Pb3O4改写成简单氧化物的形式;
Ⅱ.(2)根据流程图,步骤①中加入(NH4)2CO3的目的是“脱硫”,将PbSO4转化为PbCO3,据此书写反应的离子方程式;①根据 “脱硫过程”的装置图和反应的转化温度为35℃分析解答;②PbO2具有强氧化性,能够将双氧水氧化,据此书写反应的化学方程式;
(3)为检验CO和CO2两种气体,需要首先检验二氧化碳,然后将CO转化为二氧化碳进行检验,在检验CO前需要检查剩余气体中不存在二氧化碳,同时防止尾气中的CO污染空气,据此分析判断装置连接的合理顺序;
(4)①滴定管未用EDTA标准液润洗,使得EDTA标准液浓度偏小,滴定过程中消耗的EDTA标准液体积偏大,据此分析判断;②反应的方程式为Pb2++ H2Y 2-=PbY2-+2H+,平行滴定三次,平均消耗EDTA标准溶液14. 52 mL,根据方程式有n(PbC2O4)=n(Pb2+)=n(H2Y 2-),据此分析计算草酸铅的纯度。
I.(1)铅能形成多种氧化物,如碱性氧化物PbO、酸性氧化物PbO2,表明Pb元素常见的化合价为+2价和+4价,则Pb3O4改写成简单氧化物的形式为2PbO·PbO2,故答案为:2PbO·PbO2;
Ⅱ.(2)根据流程图,步骤①的目的是“脱硫”,将PbSO4转化为PbCO3,反应的离子方程式为CO32-+ PbSO4= SO42-+ PbCO3,故答案为:CO32-+ PbSO4= SO42-+ PbCO3;
①根据 “脱硫过程”的装置图,仪器a为三颈烧瓶;反应的转化温度为35℃,合适加热方式为水浴加热,故答案为:三口烧瓶;热水浴;
②PbO2具有强氧化性,能够将双氧水氧化,反应的化学方程式为PbO2+ H2O2+2HNO3=Pb(NO3)2+2H2O+O2↑,故答案为:PbO2+ H2O2+2HNO3=Pb(NO3)2+2H2O+O2↑;
(3)草酸铅受热分解生成PbO时,还有CO和CO2生成,为检验这两种气体,需要首先检验二氧化碳,然后将CO转化为二氧化碳进行检验,在检验CO前需要检查剩余气体中不存在二氧化碳,同时防止尾气中的CO污染空气,因此装置连接的合理顺序为ABCBDEBF;E中黑色固体粉末变为红色,其后的B装置中澄清石灰水变浑浊,能够证明产物中有CO气体,故答案为:BCBDEBF;E中黑色固体粉末变为红色,其后的B装置中澄清石灰水变浑浊;
(4)①滴定管未用EDTA标准液润洗,使得EDTA标准液浓度偏小,滴定过程中消耗的EDTA标准液体积偏大,导致测定结果偏高,故答案为:偏高;
②称取2.5 g样品,酸溶后配制成250 mL溶液,然后量取25. 00 mL该溶液,用0. 050 00 mol/L的EDTA(Na2H2Y)标准溶液滴定其中的Pb2+,反应的方程式为Pb2++ H2Y 2-=PbY2-+2H+,平行滴定三次,平均消耗EDTA标准溶液14. 52 mL,则n(PbC2O4)=n(Pb2+)=n(H2Y 2-)=0.01452L×0. 050 00 mol/L,则250 mL溶液中n(PbC2O4)= 0.01452L×0. 050 00 mol/L×![]() ,因此草酸铅的纯度=
,因此草酸铅的纯度=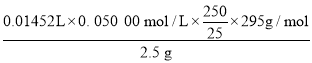 ×100%=85.67%,故答案为:Pb2++ H2Y 2-=PbY2-+2H+;85.67%。
×100%=85.67%,故答案为:Pb2++ H2Y 2-=PbY2-+2H+;85.67%。


科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法不正确的是
A. 向![]() 溶液中通入
溶液中通入![]() ,
,![]() 减小
减小
B. 将![]() 的
的![]() 溶液从
溶液从![]() 升温至
升温至![]() ,
,![]() 增大
增大
C. 向![]() 的HF溶液中滴加NaOH溶液至中性,
的HF溶液中滴加NaOH溶液至中性,![]() =1
=1
D. 向![]() 的
的![]() 溶液中加入少量水,
溶液中加入少量水,![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以A、B、C为原料制取药物AspirinSustained-ReleaseTablets(缓释阿司匹林)的合成路线如图:

已知:ⅰ.A、B为烃,其中A的产量可作为石油化工水平的标志;
ⅱ. 。
。
回答下列问题:
(1)Z所含官能团名称为___。
(2)B和Y的结构简式为__、__。
(3)完成方程式:
①X→CH2OHCH2OH__。
②C→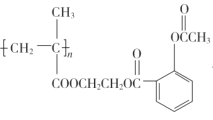 __。
__。
(4)满足以下条件的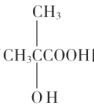 的同分异构体共有__种(不含立体异构),其中核磁共振氢谱峰面积比为6:1:1的同分异构体的结构简式为__。
的同分异构体共有__种(不含立体异构),其中核磁共振氢谱峰面积比为6:1:1的同分异构体的结构简式为__。
a.能发生水解反应 b.能与钠反应放出氢气 c.能发生银镜反应
(5)以乳酸(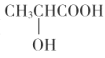 )和甲醇为原料,其他无机试剂任选,设计合成
)和甲醇为原料,其他无机试剂任选,设计合成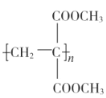 的路线:__。
的路线:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍是一种用途广泛的金属,常用于电镀工业和制造电池。镍易形成Ni(CO)4、[Ni(NH3)6]SO4等配合物。
(1)镍基态原子的核外电子排布式为________。
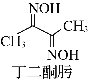
(2)Ni2+可用丁二酮肟检验。丁二酮肟的结构如图所示,其分子中碳原子轨道的杂化类型为________。
(3)与CO互为等电子体的阴离子的化学式为__________________。
(4)1 mol [Ni(NH3)6]SO4中σ键的数目为________。氨的沸点高于膦(PH3),原因是____________________________。
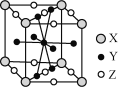
(5)镧镍合金是较好的储氢材料。储氢后所得晶体的化学式为LaNi5H6,晶胞结构如图所示,X、Y、Z表示储氢后的三种微粒,则图中Z表示的微粒为________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)电炉加热时用纯O2氧化管内样品,根据产物的质量确定有机物的组成.下列装置是用燃烧法确定有机物分子式常用的装置.

(1)产生的O2按从左到右的流向,所选装置各导管的正确连接顺序是
(2)C装置中浓硫酸的作用是 .
(3)D装置中MnO2的作用是 .
(4)燃烧管中CuO的作用是 .
(5)若实验中所取样品只含C、H、O三种元素中的两种或三种,准确称取0.92g样品,经充分反应后,A管质量增加1.76g,B管质量增加1.08g,则该样品的实验式为 .
(6)用质谱仪测定其相对分子质量,得如图二所示的质谱图,则该有机物的相对分子质量为 .
(7)能否根据A的实验式确定A的分子式 (填“能”或“不能”),若能,则A的分子式是 (若不能,则此空不填).
(8)该物质的核磁共振氢谱如图三所示,则其结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的数值,下列说法不正确的是( )
A.电解精炼铜时,若阳极质量减少64 g,则转移到阴极的电子数不一定等于2NA
B.18 g氨基(-ND2)中含有的电子数为10NA
C.用惰性电极电解100 mL 0.1 mol·L-1的CuSO4溶液,当阴、阳两极产生相同条件下等体积的气体时,电路中转移电子数为0. 04NA
D.工业合成氨每断裂NA个N≡N键,同时断裂6NA个N-H键,则反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示。常温下S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法错误的是( )

A. S2Cl2的结构式为Cl-S-S-Cl
B. S2Cl2为含有极性键和非极性键的非极性分子
C. S2Br2与S2Cl2结构相似,分子间作用力:S2Br2>S2Cl2
D. S2Cl2与H2O反应的化学方程式可能为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁氮化合物(![]() )在磁记录材料领域有着广泛的应用前景。某
)在磁记录材料领域有着广泛的应用前景。某![]() 的制备需铁、氮气、丙酮和乙醇参与。
的制备需铁、氮气、丙酮和乙醇参与。
(1)![]() 基态核外电子排布式为_______。
基态核外电子排布式为_______。
(2)丙酮(![]() )分子中碳原子轨道的杂化类型是_______,1mol丙酮分子中含有σ键的数目为______________。
)分子中碳原子轨道的杂化类型是_______,1mol丙酮分子中含有σ键的数目为______________。
(3)C、H、O三种元素的电负性由小到大的顺序为_____。
(4)乙醇的沸点高于丙酮,这是因为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用铜阳极泥(主要成分是Cu2Te,含Ag、Au等杂质)为原料提取碲并回收金属,其工艺流程如下:
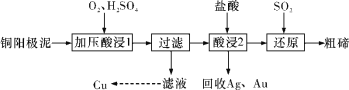
已知:TeO2是两性氧化物,微溶于水,易溶于较浓的强酸和强碱。下列说法错误的是
A.“加压酸浸1”过程中将碲元素转化成TeO2,应严格控制溶液的pH值
B.“酸浸2”过程中温度不能过高,否则会使碲的浸出率降低
C.从Ag和Au中分离出Au,应该向回收的Ag和Au中加入稀氨水
D.“还原”反应中发生的离子方程式为:TeO2+2SO2+2H2O=Te+2SO42-+4H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com