下列说法正确的是( )
A.常温下,将pH=11的氨水稀释到原体积的10倍后,溶液的pH=10
B.为确定某酸.H2A是强酸还是弱酸,可测NaHA溶液的pH,若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸
C.用0.2000mol/L NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1mol/L),至中性时,溶液中的酸未被完全中和
D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水②0.1mol/L盐酸 ③0.1mol/L氯化镁溶液④0.1mol/L硝酸银溶液中,则Ag+浓度:①>④=②>③
【答案】
分析:A.一水合氨是弱电解质,加水稀释氨水会促进一水合氨电离;
B.判断强酸、弱酸的依据是该酸是否完全电离,NaHA溶液的pH>7说明H
2A的二级电离,不完全电离,即HA
-为弱酸,可以说明H
2A是弱酸,NaHA溶液的pH<7,H
2A是强酸或弱酸都有可能.
C、NaOH滴定HCl与CH
3COOH,醋酸是弱电解质,若碱与酸恰好反应,溶液中溶质为氯化钠、醋酸钠,醋酸根水解溶液呈碱性,反应呈中性,溶液中的酸有剩余.
D、氯化银难溶于水,在水中的溶解度很小,一定温度下,溶液中Ksp(AgCl)=c(Ag
+)?c(Cl
-)为定值,溶液中c(Cl
-)越大,c(Ag
+)越小.
解答:解:A.一水合氨是弱电解质,加水稀释氨水会促进一水合氨电离,导致氢氧根离子浓度大于原来的
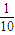
,所以溶液的11>pH>10,故A错误;
B、NaHA溶液的pH>7说明H
2A的二级电离不完全,即HA
-为弱酸,所以可以说明H
2A是弱酸,NaHA溶液的pH<7,H
2A是强酸或弱酸都有可能,如硫酸、亚硫酸,故B错误;
C、NaOH滴定HCl与CH
3COOH,醋酸是弱电解质,若碱与酸恰好反应,溶液中溶质为氯化钠、醋酸钠,醋酸根水解溶液呈碱性,反应呈中性,溶液中的酸有剩余,故C正确;
D、氯化银难溶于水,在水中的溶解度很小,一定温度下,溶液中Ksp(AgCl)=c(Ag
+)?c(Cl
-)为定值,①蒸馏水中没有氯离子、②0.1mol/L盐酸中c(Cl
-)=0.1mol/L,③0.1 mol/L氯化镁溶液c(Cl
-)=0.2mol/L、④0.1mol/L硝酸银溶液中c(Ag
+)=0.1mol/L,溶液中c(Ag
+)为④>①>②>③,故D错误.
故选:C.
点评:考查强弱电解质、弱电解质的电离、盐类水解、溶度积及相关计算等,难度中等,注意把握强弱电解质关键是电解质是否完全电离.

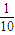 ,所以溶液的11>pH>10,故A错误;
,所以溶液的11>pH>10,故A错误;


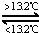 Sn(s,白)△H3=+2.1kJ?mol-1,
Sn(s,白)△H3=+2.1kJ?mol-1,