
 乙苯催化脱氢生产苯乙烯的反应:
乙苯催化脱氢生产苯乙烯的反应: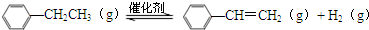
化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| 总压强/100kPa | 1.0 | 1.2 | 1.3 | 1.4 | 1.4 |
分析 (1)根据△H=反应物总键能-生成物总键能,由有机物的结构可知,应是-CH2CH3中总键能与-CH=CH2、H2总键能之差,计算可得;
(2)①根据压强与气体物质的量成正比确定反应后气体的总物质的量;利用差量法计算出反应消耗乙苯的物质的量,然后计算出乙苯的转化率;
②利用三段式计算出平衡时各组分的物质的量,然后利用平衡常数表达式计算出该温度下该反应的平衡常数;
(3)①图象分析可知,随温度升高,乙苯转化率增大,说明升温平衡正向进行,正反应为吸热反应,AB两点B点温度高;
②乙苯量越多,投料比越小,乙苯转化率越小,据此分析判断M的值;
③①CO2与H2反应,导致氢气浓度减低,有利于乙苯脱氢反应的化学平衡右移;
②由题目信息可知,在保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度,消耗的能量减少;
③由于会发生反应CO2+C═2CO,有利于减少积炭;
④CO2代替水蒸气,有利用CO2资源利用.
解答 解:(1)反应热=反应物总键能-生成物总能键能,由有机物的结构可知,应是-CH2CH3中总键能与-CH=CH2、H2总键能之差,故△H=(5×412+348-3×412-612-436)kJ•mol-1=+124kJ•mol-1;
故答案为:+124;
(2)①容器容积固定,则容器内压强与气体的总物质的量成正比,根据表中数据可知,达到平衡时压强为反应前的1.4倍,则平衡时气体的总物质的量为:amol×1.4=1.4amol;
平衡时气体的物质的量增大:1.4amol-amol=0.4amol,设有x mol 乙苯发生转化, △n
△n
1 1 1 1
xmol 0.4amol
则:x=$\frac{0.4amol×1}{1}$=0.4amol,
所以乙苯的转化率为:$\frac{0.4amol}{amol}$×100%=40%,
故答案为:1.4a;40%;
②发生反应为
反应前(mol) a 0 0
转化(mol) 0.4a 0.4a 0.4a
平衡时(mol) 0.6a 0.4a 0.4a
则该反应的平衡常数为:K=$\frac{(0.4a÷V)•(0.4a÷V)}{(0.6a÷V)}$=$\frac{4a}{15V}$;
故答案为:$\frac{4a}{15V}$;
(3)①图象分析可知,随温度升高,乙苯转化率增大,说明升温平衡正向进行,正反应为吸热反应,AB两点B点温度高,平衡正向进行程度大,平衡常数B点大,KA<KB,
故答案为:<;
②乙苯量越多,投料比越小,乙苯转化率越小,据此分析判断M的值,M1>M2>M3,
故答案为:M1>M2>M3;
(4)①CO2与H2反应,导致氢气浓度减低,有利于乙苯脱氢反应的化学平衡右移,故正确;
②由题目信息可知,在保持常压和原料气比例不变,与掺水蒸汽工艺相比,在相同的生产效率下,可降低操作温度,消耗的能量减少,故正确;
③由于会发生反应CO2+C═2CO,有利于减少积炭,故正确;
④CO2代替水蒸气,有利用CO2资源利用,故正确;
故答案为:①②③④.
点评 本题考查反应热计算、化学平衡常数计算、反应速率及平衡移动的影响因素、对条件控制的分析评价等,注意(1)中苯环不影响计算结构、反应热有符号,学生易遗漏,注意掌握三段式在化学平衡的计算中的应用方法,试题培养了学生的分析能力及化学计算能力,题目难度较大.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2017届安徽省黄山市高三上月考二化学卷(解析版) 题型:实验题
某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验I.制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60 ℃时NaClO2分解成NaClO3和NaCl。现利用下图所示装置进行实验。

(1) 装置③的作用是 。
(2) 装置②中产生ClO2的化学方程式为 ;装置④中制备NaClO2的化学方程式为 。
(3) 从装置④反应后的溶液获得NaClO2晶体的操作步骤如下:
① 减压,55 ℃蒸发结晶;② 趁热过滤;③ ;④ 低于60 ℃干燥,得到成品。
实验II.测定某亚氯酸钠样品的纯度
设计如下实验方案,并进行实验:
① 确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2- + 4 I- + 4 H+ = 2 H2O + 2 I2 + Cl-);将所得混合液配成250 mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用cmol·L-1Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为VmL(已知:I2+2S2O32-=2I-+S4O62-)。
(4) 达到滴定终点时的现象为 。
(5) 该样品中NaClO2的质量分数为 (用含m、c、V的代数式表示)。
(6) 在滴定操作正确无误的情况下,此实验测得结果偏高,原因用离子方程式表示为 。
查看答案和解析>>
科目:高中化学 来源:2017届重庆一中高三上学期第二次月考化学试卷(解析版) 题型:实验题
2Zn(OH)2·ZnCO3是制备活性ZnO的中间体,以锌焙砂(主要成分为ZnO,含少量Cu2、Mn2+等离子)为原料制备2Zn(OH)2·ZnCO3的工艺流程如下:
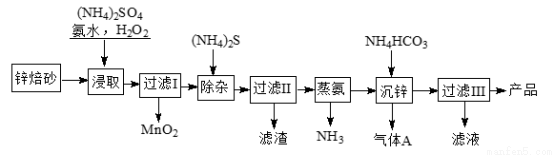
请回答下列问题:
(1)当(NH4)2SO4、NH3·H2O的混合溶液中存在c(NH4+)=2c(SO42?)时,溶液呈 (填“酸”、“碱”或“中”)性。
(2)“浸取”时为了提高锌的浸出率,可采取的措施是 (任写两种)。
(3)“浸取”时加入的NH3·H2O过量,生成MnO2的离子方程式为 。
(4)适量S2?能将Cu2+硫化物沉淀而除去,若选择ZnS进行除杂,是否可行?用计算说明原因: 。
[已知:Ksp(ZnS)=1.6×10?24,Ksp(CuS)=1.3×10?36;一般认为反应的平衡常数K>105,该反应进行基本完全。]
(5)“沉锌”的离子方程式为___________________。
(6)上述流程中多次需要过滤,实验室进行过滤操作需要用到的玻璃仪器有__________。“过滤III”所得滤液可循环使用,产品需洗涤干燥后备用,检验产品洗涤干净的操作和现象是_______________。
查看答案和解析>>
科目:高中化学 来源:2017届重庆一中高三上学期第二次月考化学试卷(解析版) 题型:选择题
从海带中制取单质碘需要经过灼烧、溶解、过滤、氧化、萃取、分液、蒸馏等操作。下列图示对应的装置合理、操作规范的是
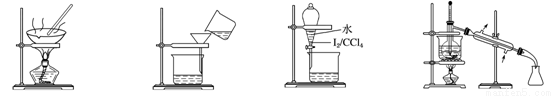
A.灼烧 B.过滤 C.分液 D.蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 化学键 | N≡N | H-O | O-O | H-N |
| E/kJ•mol-1 | a | b | c | d |
| 实验编号 | 温度 | 起始时物质的量/mol | 平衡时物质的量/mol | |
| N(SO2) | N(NO2) | N(NO) | ||
| 甲 | T1 | 0.80 | 0.20 | 0.18 |
| 乙 | T2 | 0.20 | 0.80 | 0.16 |
| 丙 | T3 | 0.20 | 0.30 | a |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
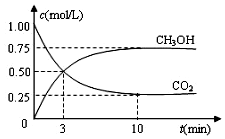 目前工业上可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.现向体积为1L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示.
目前工业上可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.现向体积为1L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨的合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ•mol-1.现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图.
氨的合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ•mol-1.现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图.| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com