
【题目】现有金属单质A和气体甲、乙、丙及物质B、C、D、E、F、G,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
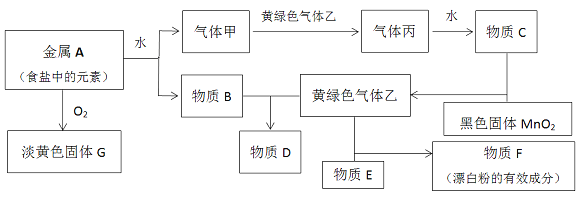
请根据以上信息回答下列问题:
(1)写出下列物质的名称:丙D
写出下列物质的化学式:F G
(2)写出下列反应的化学方程式:
①金属A和水
②物质B和气体乙
③物质E和气体乙
④实验室制备气体乙
⑤固体G与CO2
(3)用化学方程式解释F长期放置在空气中失效的原因: 。
【答案】
(1)氯化氢;次氯酸钠或氯化钠;Ca(ClO)2;Na2O2
(2)①2Na+2H2O=2NaOH+H2↑;
②Cl2+2NaOH=NaCl+NaClO+H2O
③2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
④MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
⑤2Na2O2+2CO2==2Na2CO3+O2
(3)Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO;2HClO![]() 2HCl+O2↑
2HCl+O2↑
【解析】
试题分析:根据图示,黄绿色气体乙为氯气,二氧化锰与物质C反应生成氯气,C为浓盐酸,则气体丙为氯化氢,气体甲为氢气,金属A为食盐中的元素,为钠,钠与氧气反应生成淡黄色固体G,G为过氧化钠;钠与水反应生成氢气和氢氧化钠,B为氢氧化钠,氢氧化钠和氯气反应生成物质D,D为次氯酸钠或氯化钠;氯气与物质E反应生成漂白粉,E为氢氧化钙。
(1)根据上述分析,丙为氯化氢;D为次氯酸钠或氯化钠
写出下列物质的化学式:F为Ca(ClO)2;G为Na2O2,故答案为:氯化氢;次氯酸钠或氯化钠;Ca(ClO)2;Na2O2;
(2)反应的化学方程式分别为①金属A和水:2Na+2H2O=2NaOH+H2↑,故答案为:2Na+2H2O=2NaOH+H2↑;
②物质B和气体乙:Cl2+2NaOH=NaCl+NaClO+H2O,故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
③物质E和气体乙:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
④实验室制备气体乙:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
⑤固体G与CO2:2Na2O2+2CO2==2Na2CO3+O2,故答案为:2Na2O2+2CO2==2Na2CO3+O2;
(3)Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO;2HClO![]() 2HCl+O2↑
2HCl+O2↑
(3)次氯酸钙长期放置在空气中,与空气中二氧化碳和水蒸气反应而失效,反应的方程式为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO;2HClO![]() 2HCl+O2↑,故答案为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO;2HClO
2HCl+O2↑,故答案为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO;2HClO![]() 2HCl+O2↑。
2HCl+O2↑。


 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:
【题目】下列哪些生理活动会导致细胞内ADP的含量增加 ( )
①小肠绒毛上皮细胞吸收K+和Na+
②肾小管对葡萄糖的重吸收
③血液中的葡萄糖进入红细胞
④甘油进入小肠绒毛上皮细胞
A.①②③④ B.①② C.③④ D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸钴[Co4(OH),(CO3)4]常用作电子材料、磁性材料的添加剂,难溶于水,受热时可分解生成三种氧化物。为了确定其组成,某化学兴趣小组同学设计了如图所示的装置(不完整)进行试验。
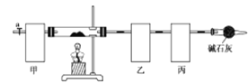
实验步骤如下:
①称取3.65g样品置于硬质玻璃管内,称量乙、丙装置的质量;
②按如图所示装置组装好仪器,…… ;
③加热硬质玻璃管,当乙装置中 ……,停止加热;
④打开活塞a,缓缓通入空气数分钟后,称量乙、丙装置的质量;
⑤计算。
(1)从下列图示选出合理的装置填于方框中,使整套实验装置完整(选填字母序号,可重复选)

甲: 乙: 丙:
甲装置的作用是 。
(2)步骤②中省略的实验操作为 ;
步骤③中乙装置的现象为 ;
步骤④中缓缓通入空气数分钟的目的是 。
(3)若按正确装置进行实验,测得如下数据。
乙装置的质量/g | 丙装置的质量/g | |
加热前 | 80.00 | 62.00 |
加热后 | 80.36 | 62.88 |
则该碱式碳酸钴的化学式为_____________。
(4)CO2和SO2均为酸性气体,性质相似。为了比较亚硫酸和碳酸的酸性强弱,某同学用如下装置进行实验。

①写出该实验能达到实验目的的实验现象____________。
②若将SO2通入水中至饱和,请设计实验证明亚硫酸是弱酸,实验方案为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于气体体积,下列叙述正确的是
A.1mol任何气体的体积一定是22.4L
B.同温同压下两种气体,只要它们的分子数相同,所占体积也一定相同
C.在标准状况下,体积为22.4L的物质都是1mol
D.在非标准状况下,1mol任何气体的体积不可能是22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个体积为2 L的密闭容器中,高温下发生反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g)。其中CO2、CO的物质的量(mol)随时间(min)的变化关系如图所示。
FeO(s)+CO(g)。其中CO2、CO的物质的量(mol)随时间(min)的变化关系如图所示。

(1)反应在1 min时第一次达到平衡状态,固体的质量增加了3.2 g。用CO2的浓度变化表示的反应速率v(CO2)= 。
(2)反应进行至2 min时,若只改变温度,曲线发生的变化如图所示,3 min时再次达到平衡,则ΔH 0(填“>”“<”或“=”)。
(3)5 min时再充入一定量的CO(g),平衡发生移动。下列说法正确的是 (填写编号)。
A.v(正)先增大后减小 B.v(正)先减小后增大
C.v(逆)先增大后减小 D.v(逆)先减小后增大
表示n(CO2)变化的曲线是 (填写图中曲线的字母编号)。
(4)请用固态物质的有关物理量来说明该反应已经达到化学平衡状态: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。
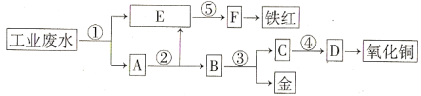
填写下面空白。
(1)图中标号处需加入的相应物质分别是① 、② 、③ 、④ 、⑤ ;
(2)写出①处发生反应的离子方程式 ;写出③处发生反应的化学方程式 ;
(3)铁红的化学式为 ;分别写出铁红和氧化铜在工业上的一种主要用途:铁红 ;氧化铜 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生态溶液涉及农家肥料的综合利用,某种肥料经发酵得到一种含有甲烷、二氧化碳、氮气的混合气体。2.016L(标准状况)该气体通过盛有红色CuO粉末的硬质玻璃管,发生的反应为:CH4+4CuO![]() CO2+2H2O+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻4.8g。将反应后产生的气体通过过量的澄清石灰水,充分吸收,生成沉淀8.5g。
CO2+2H2O+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻4.8g。将反应后产生的气体通过过量的澄清石灰水,充分吸收,生成沉淀8.5g。
(1)原混合气体中甲烷的物质的量是____________。
(2)原混合气体中氮气的体积分数为多少?(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中欲加速制取氢气,最好的方法是用()
A.纯锌与稀硫酸反应 B.纯锌与浓硫酸反应
C.纯锌与稀盐酸反应 D.粗锌(含铝、铜等杂质)与稀硫酸反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com