
【题目】(1)微型纽扣电池在现代生活中有广泛应用.有一种银锌电池,其电极分别是![]() 和
和![]() ,电解质溶液为
,电解质溶液为![]() 溶液,电极反应为:
溶液,电极反应为:![]() ,
,![]() 。根据上述反应式,完成下列题目。
。根据上述反应式,完成下列题目。

①下列叙述正确的是_______。
![]() .在使用过程中,K+流向Zn极
.在使用过程中,K+流向Zn极
![]() .使用过程中,电子由
.使用过程中,电子由![]() 极经外电路流向
极经外电路流向![]() 极
极
![]() .
.![]() 是负极,
是负极,![]() 是正极
是正极
![]() .
.![]() 电极发生还原反应,
电极发生还原反应,![]() 电极发生氧化反应
电极发生氧化反应
②写出电池的总反应式:________________________________________________________________ 。
③使用时,电解质溶液的![]() ________。
________。
(2)铅蓄电池是典型的可充型电池,电池总反应式为:Pb+PbO2+4H++2SO42-2PbSO4+2H2O,请回答下列问题:①放电时,正极的电极反应式是 _____________________________________________________________________;
②电解液中![]() 的浓度将变_______;
的浓度将变_______;
③当外电路通过![]() 电子时,理论上负极板的质量增加_______
电子时,理论上负极板的质量增加_______![]() 。
。
【答案】C Zn+Ag2O=2Ag+ZnO 不变 PbO2+2e+4H++2SO42=PbSO4+2H2O 小 48
【解析】
(1)①原电池是将化学能转化为电能的装置,原电池中负极上失电子发生氧化反应,正极上得电子发生还原反应,在得失电子相等的条件下,将正负电极上电极反应式相加即得电池反应式,根据电极反应判断溶液pH的变化;
②负极电极反应式为Zn+2OH--2e-=ZnO+H2O、正极电极反应式为 Ag2O+H2O+2e-=2Ag+2OH-,所以电池反应式为Zn+Ag2O=2Ag+ZnO;
③该原电池中,Zn元素化合价由0价变为+2价、Ag元素化合价由+1价变为0价,所以Zn是负极失电子发生氧化反应,Ag2O是正极得电子发生还原反应;负极的电极反应式为:Zn+2OH--2e-=ZnO+H2O,则负极附近pH减小;正极电极反应式为 Ag2O+H2O+2e-=2Ag+2OH-,所以正极溶液的pH增大,电子转移相等的情况下负极消耗的氢氧根与正极产生的氢氧根离子的物质的量相等,所以溶液的pH值不变;
(2)电池总反应式为:Pb+PbO2+4H++2SO42-2PbSO4+2H2O,写出电极反应为:负极电解反应:Pb-2e-+SO42-=PbSO4 ,正极电极反应:PbO2+2e-+4H++2SO42-=PbSO4+2H2O,依据电解反应和电池原理分析判断。
(1)①A.原电池中阳离子流向正极,即![]() 极,故A错误;
极,故A错误;
B.由电极反应式可知,Zn的化合价由0价升高到+2价,被氧化,为原电池的负极,则正极为Ag2O,原电池中电子从负极流向正极,即从锌经导线流向Ag2O,故B错误;
C.正极电极反应为:Ag2O+H2O+2e-=2Ag+2OH-,负极电极反应:Zn+2OH-═Zn(OH)2+2e-,所以Zn是负极,Ag2O是正极,故C正确;
D.由电极反应式可知,Zn的化合价由0价升高到+2价,为原电池的负极,发生氧化反应,Ag2O是正极发生还原反应,故D错误;
故答案为C;
②负极电极反应式为Zn+2OH--2e-=ZnO+H2O、正极电极反应式为 Ag2O+H2O+2e-=2Ag+2OH-,所以电池反应式为Zn+Ag2O=2Ag+ZnO;
③该原电池中,Zn元素化合价由0价变为+2价、Ag元素化合价由+1价变为0价,所以Zn是负极失电子发生氧化反应,Ag2O是正极得电子发生还原反应;负极的电极反应式为:Zn+2OH--2e-=ZnO+H2O,则负极附近pH减小;正极电极反应式为 Ag2O+H2O+2e-=2Ag+2OH-,所以正极溶液的pH增大,电子转移相等的情况下负极消耗的氢氧根与正极产生的氢氧根离子的物质的量相等,所以溶液的pH值不变。
(2)①电池总反应式为:Pb+PbO2+4H++2SO42-2PbSO4+2H2O,放电时正极上发生还原反应,电极反应式是PbO2+2e-+4H++2SO42-=PbSO4+2H2O;
②放电时消耗负极上发生氧化反应,电极反应为Pb-2e-+SO42-=PbSO4 ,结合正极反应PbO2+2e-+4H++2SO42-=PbSO4+2H2O,可知电解液中H2SO4的浓度将减少;
③当外电路通过1mol电子时,依据电子守恒计算理论上负极板的质量增加0.5mol×303g/mol-0.5mol×207g/mol=48g。


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】下表为周期表前20号元素中某些元素的有关数据:
元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
原子半径(10-10m) | 1.86 | 1.52 | 0.66 | 0.53 | 0.77 | 1.10 | 0.99 | 2.31 | 0.70 |
最高价态 | +1 | +1 | —— | +1 | +4 | +5 | +7 | +1 | +5 |
最低价态 | —— | —— | -2 | -1 | -4 | -3 | -1 | —— | -3 |
试回答下列问题:(用对应具体符号或名称表示)
(1)以上9种元素的原子中,还原性最强的是________(名称),写出它的原子结构示意图:___________________ ;
(2)③与④可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式:________________________________________(分解反应)。
(3)某元素R的原子半径为1.04×10-10m,该元素在周期表中的位置是_______________
(4)①、③、⑦三种元素形成的离子,其半径由小到大的顺序为_______________
(5)下列事实能说明元素⑦的非金属性比硫元素的非金属性强的是___________。
a.元素⑦形成的单质比硫元素形成的单质的熔点低
b.元素⑦和硫两元素的简单氢化物受热分解,前者的分解温度高
c.元素⑦的单质通入到H2S的溶液中出现浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X的键线式为: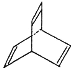
(1)有机物Y是X的同分异构体,且属于芳香烃,写出Y的结构简式________________;
(2)Y与乙烯在一定条件下发生等物质的量聚合反应,写出其反应的化学方程式:__________;
(3)X与足量的H2在一定条件下反应可生成环状的饱和烃Z,则Z的一氯代物有______种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新鲜水果、蔬菜、乳制品中富含的维生素C具有明显的抗衰老作用,但易被空气氧化。某课外小组利用碘滴定法测定某橙汁中维生素C的含量,其化学方程式为:

下列说法中,正确的是( )
A. 上述反应为取代反应 B. 滴定时可用淀粉溶液作指示剂
C. 滴定时剧烈振荡锥形瓶 D. 维生素C的分子式为C6H8O6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)常用作氯化剂和氯磺化剂,在染料、药品、除草剂和农用杀虫剂的生产过程中有重要作用。现在拟用干燥的Cl2和SO2在活性炭催化下制取硫酰氯。反应的化学方程式为:SO2(g)+ Cl2(g) =SO2Cl2(l) ΔH =97.3 kJ·mol1,实验装置如图所示(部分夹持装置未画出)。

已知:硫酰氯通常条件下为无色液体,熔点54.1℃,沸点69.1℃。在潮湿空气中“发烟”;长期放置或者100°C以上发生分解,生成二氧化硫和氯气。回答下列问题:
(1)仪器C的名称是_______________,冷凝管的进水方向______(填“a”或“b”)。
(2)下列操作或描述正确的是_________________。
A.将70%硫酸换成98.3%硫酸,可以加快制取SO2的速率
B.实验中通过观察乙、丁导管口产生气泡的速率相等,可控制两种反应物体积相等
C.装置戊上方分液漏斗中最好选用0.10 molL-1NaCl溶液,减小氯气的溶解度
D.装置己防止污染,又防止硫酰氯变质
(3)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯,写出反应方程式:____________________。
(4)硫酰氯在潮湿空气中“发烟”,原因是_______________________(用化学方程式表示)。
(5)若反应中消耗的二氧化硫体积为560 mL(标准状况下),最后经过分离提纯得到2.7 g纯净的硫酰氯,则硫酰氯的产率为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学式为C8H10O的化合物A具有如下性质:①A+Na→慢慢产生气泡 ②A+RCOOH![]() 有香味的产物 ③A
有香味的产物 ③A![]() 苯甲酸 ④催化脱氢产物不能发生银镜反应 ⑤脱水反应的产物,经聚合反应可制得一种塑料制品(它是目前造成“白色污染”主要的污染源之一)。
苯甲酸 ④催化脱氢产物不能发生银镜反应 ⑤脱水反应的产物,经聚合反应可制得一种塑料制品(它是目前造成“白色污染”主要的污染源之一)。
试回答:
(1)根据上述信息,对该化合物的结构?可作出的判断是___________。
a.苯环上直接连有羟基 b.肯定有醇羟基
c.苯环侧链末端有甲基 d.肯定是芳香烃
(2)化合物A的结构简式____________________。
(3)A和金属钠反应的化学方程式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物W、X、Y、Z的分子式均为C7H8,Z的空间结构类似于篮子。下列说法正确的是
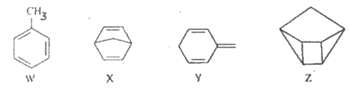
A. Z的一氯代物只有3种
B. 化合物W的同分异构体只有X、Y、Z
C. X、Y、Z均可与酸性KMnO4溶液反应
D. 1molX、1molY与足量Br2/CCl4溶液反应最多消耗Br2均为2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2O4(g)![]() 2NO2(g) △H=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2NO2(g) △H=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )

A. a、c两点的反应速率:a>c
B. a、c两点气体的颜色:a深,c浅
C. b、c两点的转化率:b>c
D. 由b点到a点,可以用加热的方法
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com