
【题目】将0.4g NaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
A. B.
B.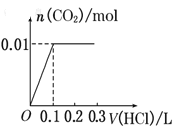
C.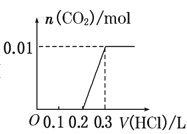 D.
D.
【答案】C
【解析】
对NaOH和Na2CO3混合配成的溶液,当滴加盐酸时,先发生NaOH+HCl=NaCl+H2O,再发生Na2CO3+HCl=NaCl+NaHCO3,最后发生NaHCO3+HCl=NaCl+CO2↑+H2O,有二氧化碳气体生成,利用物质的量的关系并结合图象解析。
0.4g NaOH的物质的量为0.4g÷40g·mol-1=0.01mol和1.06gNa2CO3的物质的量为1.06g÷106g·mol-1=0.01mol,则
A、0.1L盐酸与氢氧化钠反应没有气体生成,但碳酸钠与盐酸反应生成碳酸氢钠时也没有气体生成,则图象与反应不符,故A错误;
B、图象中开始反应即有气体生成,与反应不符,故B错误;
C、向NaOH和Na2CO3混合溶液中滴加盐酸时,首先和NaOH反应生成水和氯化钠,当滴入0.1L时,两者恰好反应完全;继续滴加时,盐酸和Na2CO3开始反应,首先发生HCl+Na2CO3=NaHCO3+NaCl,不放出气体,当再加入0.1L时,此步反应进行完全;继续滴加时,发生反应:NaHCO3+HCl=NaCl+H2O+CO2↑;此时开始放出气体,正好与图象相符,故C正确;
D、因碳酸钠与盐酸的反应分步完成,则碳酸钠与盐酸先反应生成碳酸氢钠和氯化钠,此时没有气体生成,则图象与反应不符,故D错误;
故选C。


科目:高中化学 来源: 题型:
【题目】按要求填空:某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)甲组同学取2mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为___。
(2)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿(主要成分为Al2O3,还有少量杂质)是提取铝的原料。提取铝的工艺流程如下:
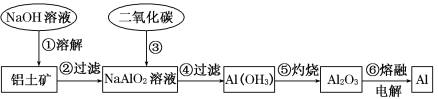
(1)请用离子方程式表示以上工艺流程中第①步反应:_____________________。
(2)写出以上工艺流程中第③步反应的离子方程式:___________________________。
(3)若第③步加入的是过量的盐酸,则发生反应的化学方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于硝酸的认识,不正确的是![]()
![]()
A. 浓硝酸在见光或受热时会发生分解 B. 久置的浓硝酸会变为稀硝酸
C. 金属与硝酸反应不产生氢气 D. 稀硝酸与铁反应而浓硝酸不与铁反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各反应中,氧化反应与还原反应在同种元素中进行的是
A.Cl2+2NaOH===NaCl+NaClO+H2O
B.2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
C.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
D.2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短同期主族元素X、Y、Z、W的原子序数依次增大。Z的简单离子半径在同周期中最小,25 ℃时, 0.01 molL 1 X、W的最高价氧化物对应的水化物溶液的pH和原子半径的关系如图所示,Y和W 同主族。下列说法错误的是 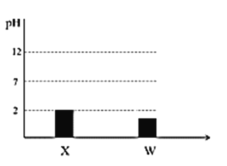
A.原子半径的大小顺序为Z>W>X>Y
B.元素Y分别与X、W元素至少形成两种化合物
C.Y、Z形成的化合物既能和酸反应又能和碱反应
D.X、Y、W对应的简单氢化物中,X的氢化物最稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒(V)是人体必需的微量元素,能预防突发性心脏病等疾病,其常见化合价有+2、+3、+4、+5,实验室模拟工业生产制备V2(CO3)3的步骤如下:
I.取18.20gV2O5放入水中搅拌形成悬浊液,在酸性条件下,通入二氯化硫充分反应可得V2(SO4)3溶液;
II.将V2(SO4)3溶液与足量的碳酸钠溶液混合,充分反应后过滤,洗涤、干燥,得V2(CO3)3固体22.56g。
已知:+5价V具有氧化性,+3价V具有还原性,易被氧气氧化。
回答下列问题:

(1)实验室用Na2SO3固体和H2SO4(浓)制取SO2,可选用的发生装置是_____(填“A”或“B”),利用下述装置制取并收集干燥的SO2,连接顺序为a—____—____—____—_____—f。
(2)步骤I的装置如下;

①盛放V2O5的仪器D的名称是_____,装置C中长颈漏斗的作用是_______。
②通入二氧化硫前和实验结束后都要通入N2,目的是________。
③写出步骤I中反应的离子方程式:___________。
(3)步骤II的洗涤操作中,证明已经洗净的方法是_________;实验中V2(CO3)3的产率为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法不正确的是( )
A.常温常压下,1.7gNH3含有NA个电子
B.标准状况下,22.4L水中含H2O分子NA个
C.1molNa完全反应生成NaCl时,失去NA个电子
D.常温常压下,22.4LCO2中含有的CO2分子数小于NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下合成乙烯:6H2(g)+2CO2(g)![]() CH2===CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )
CH2===CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )

A. 该反应的逆反应为吸热反应
B. 平衡常数:KM>KN
C. 生成乙烯的速率:v(N)一定大于v(M)
D. 当温度高于250 ℃,升高温度,催化剂的催化效率降低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com