
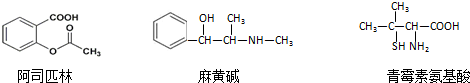
| A. | 三种有机物都能发生酯化反应 | |
| B. | 阿司匹林的苯环上的一氯代物有8种 | |
| C. | 麻黄碱的分子式是C10H15NO,苯环上的一硝基取代物有3种 | |
| D. | 青霉素氨基酸既能与盐酸反应,又能与NaOH溶液反应 |
分析 A.三种有机物分别含有羧基、羟基,都可发生酯化反应;
B.阿司匹林苯环有4种H原子;
C.根据有机物结构简式确定元素种类和原子个数,可确定有机物分子式;
D.青霉素氨基酸含有氨基,可与盐酸反应.
解答 解:A.三种有机物分别含有羧基、羟基,都可发生酯化反应,故A正确;
B.阿司匹林苯环有4种H原子,一氯代物有4种,故B错误;
C.有机物分子式为C10H15NO,苯环只有1个取代基,则对应的同分异构体有邻、间、对3种,故C正确;
D.青霉素氨基酸含有氨基,可与盐酸反应,含有羧基,可与NaOH反应,故D正确.
故选B.
点评 本题考查有机物的结构和性质,为高考常见题型,侧重于学生的分析能力的考查,本题注意把握有机物官能团的性质,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1的Na2S溶液中,S2-的数目小于0.1 NA | |
| B. | 0.1 mol丙烷中含有的共价键数目为0.8 NA | |
| C. | 标准状况下,11.2 L甲醇中含有的分子数目为0.5 NA | |
| D. | 0.1 mol氧化钠和过氧化钠的混合物中含有的离子总数为0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠的化学性质很活泼,在自然界里不能以游离态存在 | |
| B. | 化学的特征就是认识分子 | |
| C. | 在化学反应中,参加反应的各物质的质量比等于其物质的量之比 | |
| D. | 俄国化学家门捷列夫提出原子学说,为近代化学的发展奠定了坚实的基础 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C6H12,分子结构中含有3个“-CH3”原子团的烯烃共有 5种 | |
| B. | 芥子醇(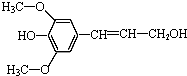 ) 能发生氧化、取代、水解、加聚反应 ) 能发生氧化、取代、水解、加聚反应 | |
| C. | 实验室制乙烯时,把生成的气体通入酸性KMnO4溶液,紫色褪去,不能说明一定生成了乙烯 | |
| D. | 将少量某物质的溶液滴加到新制银氨溶液中,水浴加热后有银镜生成,该物质不一定属于醛类 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别为 I1=738,I2=1451,I3=7733,I4=10540(单位:kJ/mol) |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
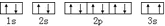 该同学所画的电子排布图违背了泡利原理.
该同学所画的电子排布图违背了泡利原理.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
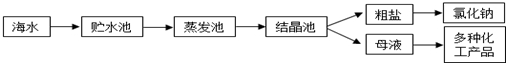
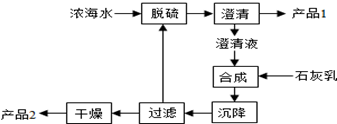
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
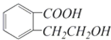 它可通过不同的反应分别得到下列物质:
它可通过不同的反应分别得到下列物质:
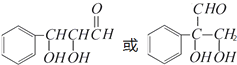 .(注:同一碳原子上连两个或两个以上羟基不稳定,故书写时排除此类化合物.)
.(注:同一碳原子上连两个或两个以上羟基不稳定,故书写时排除此类化合物.)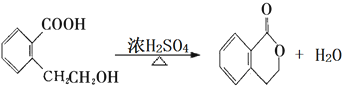 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
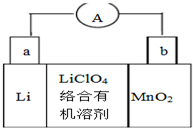 锂锰电池的体积小、性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4.溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.下列有关说法正确的是( )
锂锰电池的体积小、性能优良,是常用的一次电池.该电池反应原理如图所示,其中电解质LiClO4.溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.下列有关说法正确的是( )| A. | 外电路的电流方向是由a极流向b极 | |
| B. | 电池正极反应式为MnO2+e-+Li+=LiMnO2 | |
| C. | 可用水代替电池中的混合有机溶剂 | |
| D. | 每转移0.1mol电子,理论上消耗Li的质量为3.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
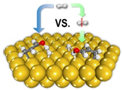 2013年《美国化学会志》发表了我国科学家对非均相催化加氢过程机理研究的成果,其原理如图.下列关于氢气的说法不正确的是( )
2013年《美国化学会志》发表了我国科学家对非均相催化加氢过程机理研究的成果,其原理如图.下列关于氢气的说法不正确的是( )| A. | 由氢原子构成的氢气分子只有一种 | |
| B. | 通常情况下,气体中氢气的密度最小 | |
| C. | 氢气可用于生产盐酸、氨气等化工产品 | |
| D. | 目前,工业上不采用电解水的方法大量生产氢气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com