
已知:P4(g)+6Cl2(g)===4PCl3(g),
ΔH=a kJ·mol-1,
P4(g)+10Cl2(g)===4PCl5(g) ΔH=b kJ·mol-1,
P4具有正四面体结构,PCl5中P—Cl键的键能为c kJ·mol-1,PCl3中P—Cl键的键能为1.2c kJ·mol-1。
下列叙述正确的是( )
A.P—P键的键能大于P—Cl键的键能
B.可求Cl2(g)+PCl3(g)===PCl5(s)的反应热ΔH
C.Cl—Cl键的键能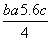 kJ·mol-1
kJ·mol-1
D.P—P键的键能为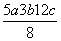 kJ·mol-1
kJ·mol-1
答案 C
解析 A项,由于氯原子半径小于磷原子半径,所以P—P键的键能应小于P—Cl键的键能,错误;
B项,由于不知PCl5(g)===PCl5(s)对应的ΔH,所以无法根据盖斯定律求得该反应的ΔH,错误;
C项,P4(g)+10Cl2(g)===4PCl5(g) ΔH=b kJ·mol-1①
P4(g)+6Cl2(g)===4PCl3(g) ΔH=a kJ·mol-1②
①-②得
Cl2(g)+PCl3(g)===PCl5(g) ΔH=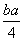 kJ·mol-1
kJ·mol-1
ECl-Cl+3×1.2c kJ·mol-1-5×c kJ·mol-1=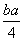 kJ·mol-1
kJ·mol-1
ECl-Cl=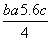 kJ·mol-1,正确;
kJ·mol-1,正确;
D项,根据P4(g)+10Cl2(g)===4PCl5(g) ΔH=b kJ·mol-1得
6EP-P+10×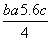 kJ·mol-1-4×5c kJ·mol-1=b kJ·mol-1
kJ·mol-1-4×5c kJ·mol-1=b kJ·mol-1
EP-P= kJ·mol-1,错误。
kJ·mol-1,错误。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
A、B、C、D都是短周期元素。A的原子核外有两个电子层,最外层已达到饱和。B位于A元素的下一周期,最外层的电子数是A最外层电子数的1/2。C的离子带有两个单位正电荷,它的核外电子排布与A元素原子相同。D与C属同一周期,D原子的最外层电子数比A的最外层电子数少1。
(1)根据上述事实判断:A是________,B是________,C是________,D是________。
(2)C的离子的核外电子排布式为________________;D原子的核外电子排布式为______________。
(3)B位于第________周期________族,它的最高价氧化物的化学式是__________,最高价氧化物的水化物是一种________酸。
查看答案和解析>>
科目:高中化学 来源: 题型:
LiH可作飞船的燃料,已知下列反应:
①2Li(s)+H2(g)===2LiH(s) ΔH=-182 kJ·mol-1
②2H2(g)+O2(g)===2H2O(l) ΔH=-572 kJ·mol-1
③4Li(s)+O2(g)===2Li2O(s) ΔH=-1 196 kJ·mol-1
试写出LiH在O2中燃烧的热化学方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:
为缓解能源紧张,越来越多的国家开始重视生物质能源(利用能源作物和有机废料,经过加工转变为生物燃料的一种能源)的开发利用。
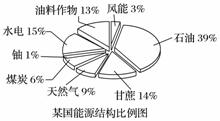
(1)如图是某国能源结构比例图,其中生物质能源所占的比例是______。
(2)生物柴油是由动植物油脂转化而来,其主要成分为脂肪酸酯,几乎不含硫,生物降解性好,一些国家已将其添加在普通柴油中使用。关于生物柴油及其使用,下列说法正确的是________。
①生物柴油是可再生资源 ②可减少二氧化硫的排放
③与普通柴油相比易分解 ④与普通柴油制取方法相同
A.①②③ B.①②④ C.①③④ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.CO2、甲烷都属于温室气体
B.用甘蔗生产的燃料乙醇属可再生能源,利用乙醇燃料不会产生温室气体
C.太阳能、风能和生物质能属于新能源
D.太阳能电池可将太阳能直接转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )
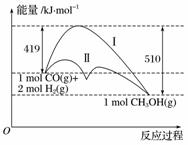
A.该反应的ΔH=91 kJ·mol-1
B.加入催化剂,该反应的ΔH变小
C.反应物的总能量大于生成物的总能量
D.如果该反应生成液态CH3OH,则ΔH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
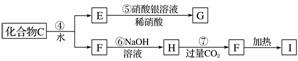
X是一种新型无机非金属材料,具有耐磨、耐腐蚀、抗冷热冲击性。有关生产过程如下:
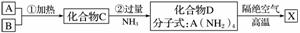
为了确定C的组成,某同学进行了以下的探究过程。已知F、G都是难溶于水和稀硝酸的白色沉淀,I可作光导纤维。
按要求回答下列问题:
(1)C的化学式为________;X的化学式为________。
(2)写出下列方程式:
反应②的化学方程式_____________________________;
反应⑦的离子方程式____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
消毒剂在生产生活中有极其重要的作用,开发具有广普、高效、低毒的杀菌剂和消毒剂是今后发展的趋势。
(1)Cl2、H2O2、ClO2(还原产物为Cl-)、O3(1 mol O3转化为1 mol O2和1 mol H2O)等物质常被用作消毒剂。等物质的量的上述物质消毒效率最高的是________(填序号)。
A.Cl2 B.H2O2
C.ClO2 D.O3
(2)H2O2有时可作为矿业废液消毒剂,有“绿色氧化剂”的美称。如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O===A+NH3↑,则生成物A的化学式为________,H2O2被称为“绿色氧化剂”的理由是__________________
________________________________________________________________________。
(3)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年。亚氯酸不稳定可分解,反应的离子方程式为HClO2—→ClO2↑+H++Cl-+H2O(未配平)。在该反应中,当有1 mol ClO2生成时转移的电子个数约为________。
(4)“84”消毒液(主要成分是NaClO)和洁厕剂(主要成分是浓盐酸)不能混用,原因是__________________(用离子方程式表示)。利用氯碱工业的产物可以生产“84”消毒液,写出有关反应的化学方程式:____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com