
| A、0.24 mol |
| B、0.21 mol |
| C、0.16 mol |
| D、0.14 mol |
| 1.344L |
| 22.4L/mol |
| 1.344L |
| 22.4L/mol |
| 0.48mol-0.06mol |
| 2 |


科目:高中化学 来源: 题型:
| A、Ag+、Ca2+、Cl-、Br- |
| B、I-、H+、SO42-、ClO- |
| C、Al3+、NH4+、Cl-、CO32- |
| D、K+、Mg2+、NO3-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、非金属元素呈现的最高正化合价数值上不超过该元素原子的最外层电子数 |
| B、非金属元素呈现的最低负化合价,其绝对值等于该元素原子的最外层电子数 |
| C、最外层有2个电子的原子都是金属原子 |
| D、最外层有5个电子的原子都是非金属原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碘水用苯萃取后,分离时,碘的苯溶液从分液漏斗下口放出 |
| B、容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无“0”刻度,滴定管有“0”刻度:使用时滴定管水洗后还需润洗,容量瓶水洗后不用润洗 |
| C、进行焰色反应时,必须用稀硫酸洗涤并灼烧珀丝,然后再进行 试验 |
| D、用干燥结晶的玻璃棒蘸取NaClO溶液,滴到放在表面皿上的pH试纸上测pH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| A2B溶液的体积(mL) | 60 | 60 | 60 | 60 | 60 | 60 | 60 |
| CD2溶液的体积(mL) | 0 | 20 | 40 | 60 | 70 | 80 | 120 |
| 沉淀质量(g) | 0 | 0.464 | 1.395 | 1.404 | 1.397 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(H+)=1.0×10-13mol/L的溶液中:K+、Na+、CH3COO-、Br- |
| B、使石蕊试纸呈红色的溶液:Na+、AlO2-、SO42-、Br- |
| C、使甲基橙变红的溶液:MnO4-、NO3-、Na+、I- |
| D、与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
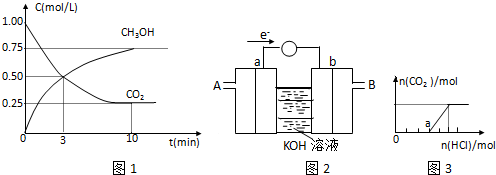
| n(CH3OH) |
| n(CO2) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com