
| A. | 离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键 | |
| B. | SiO2晶体中每个硅原子与两个氧原子以共价键相结合 | |
| C. | 金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低 | |
| D. | 晶体中分子间作用力越大,分子越稳定 |
分析 A.离子晶体中一定含有离子键,可能含有共价键,分子晶体的构成微粒是分子;
B.二氧化硅晶体中每个Si原子和四个O原子形成共价键;
C.一般来说,晶体熔沸点顺序:原子晶体>离子晶体>分子晶体,离子晶体熔沸点与离子半径成反比、与电荷成正比,分子晶体中含有氢键的熔沸点较高,原子晶体中熔沸点与键长成反比;
D.晶体的稳定性与化学键有关,与分子间作用力无关.
解答 解:A.离子晶体中一定含有离子键,可能含有共价键,如KOH等,分子晶体的构成微粒是分子,分子晶体中只含共价键不含离子键,故A错误;
B.二氧化硅晶胞结构为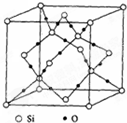 ,晶体中每个Si原子和四个O原子形成共价键,故B错误;
,晶体中每个Si原子和四个O原子形成共价键,故B错误;
C.一般来说,晶体熔沸点顺序:原子晶体>离子晶体>分子晶体,离子晶体熔沸点与离子半径成反比、与电荷成正比,分子晶体中含有氢键的熔沸点较高,原子晶体中熔沸点与键长成反比,金刚石和碳化硅是原子晶体,键长C-C<C-Si,所以熔沸点金刚石>碳化硅;氟化钠和氯化钠都是离子晶体,氟离子半径大于钠离子半径,所以熔沸点NaF>NaCl;H2O、H2S都是分子晶体,但水中含有氢键,所以熔沸点H2O>H2S,则金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低,故C正确;
D.晶体的稳定性与化学键有关,与分子间作用力无关,分子间作用力影响分子晶体熔沸点,故D错误;
故选C.
点评 本题考查晶体熔沸点高低判断、晶体稳定性影响因素、二氧化硅晶体结构等知识点,侧重考查学生分析判断能力,注意晶体类型与熔沸点的关系及影响熔沸点高低因素,易错选项是D,注意物质的稳定性与化学键有关,与分子间作用力无关,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 89.6mL | B. | 112mL | C. | 224 mL | D. | 448mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
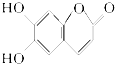
| A. | M的摩尔质量是180g/mol | |
| B. | 1 mol M最多能与2 mol Br2发生反应 | |
| C. | 1 mol M与足量NaHCO3反应能生成4 mol CO2 | |
| D. | M与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H4O5Na4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
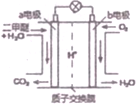 二甲醚是一种绿色、可再生的新能源,如图是绿色电源“燃料电池”的工作原理示意图(a、b均为多孔性Pt电极).该电池工作时,下列说法错误的是( )
二甲醚是一种绿色、可再生的新能源,如图是绿色电源“燃料电池”的工作原理示意图(a、b均为多孔性Pt电极).该电池工作时,下列说法错误的是( )| A. | a电极为该电池负极 | |
| B. | O2在b电极上得电子,被氧化 | |
| C. | 电池工作时,燃料电池内部H+从a电极移向b电极 | |
| D. | 电池工作时,a电极反应式:CH3OCH3-12e-+3H2O═2CO2↑+12H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| I1 | I2 | I3 | I4 | I5 | |
| 电离能/kJ•mol-1 | 738 | 1451 | 7733 | 10540 | 13630 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 牛油、纤维素和蛋白质都是天然高分子化合物 | |
| B. | 淀粉属于糖类 | |
| C. | 石油、植物油都只含有C、H两种元素 | |
| D. | 蛋白质遇硫酸铜溶液后产生的沉淀能重新溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
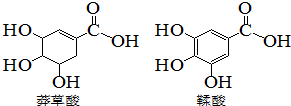 莽草酸是一种合成治疗甲型H7N9流感药物达菲的原料,鞣酸存在与苹果、生石榴等植物中,下列关于这两种有机化合物的说法错误的是( )
莽草酸是一种合成治疗甲型H7N9流感药物达菲的原料,鞣酸存在与苹果、生石榴等植物中,下列关于这两种有机化合物的说法错误的是( )| A. | 可用浓溴水区分两种酸 | |
| B. | 可用红外光谱区分两种酸 | |
| C. | 等物质的量的两种酸,分别于足量钠反应,生成氢气的质量相等 | |
| D. | 两种酸分子中所以碳原子均在同一平面上 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com